Pour décrire la répartition des électrons autour du noyau atomique, les physiciens utilisent une notation historique simple : les couches électroniques K, L, M, N, O, P et Q. Cette notation, introduite au début du XXe siècle par le physicien Charles Barkla (1877-1944) lors de l'étude des rayons X. Cette notation permet de visualiser rapidement comment les électrons se distribuent par niveaux d'énergie croissants, de la couche la plus proche du noyau (K) jusqu'aux couches externes.
Chaque lettre correspond à un nombre quantique principal n :
Couche K : n = 1 (première couche, la plus proche du noyau)
Couche L : n = 2 (deuxième couche)
Couche M : n = 3 (troisième couche)
Couche N : n = 4 (quatrième couche)
Couche O : n = 5 (cinquième couche)
Couche P : n = 6 (sixième couche)
Couche Q : n = 7 (septième couche)
Chaque couche peut contenir un nombre maximal d'électrons défini par la formule 2n² :
Couche K (n=1) : maximum 2 électrons (2 × 1² = 2)
Couche L (n=2) : maximum 8 électrons (2 × 2² = 8)
Couche M (n=3) : maximum 18 électrons (2 × 3² = 18)
Couche N (n=4) : maximum 32 électrons (2 × 4² = 32) → l'uranium l'atteint : K(2) L(8) M(18) N(32)
Couche O (n=5) : maximum 50 électrons (2 × 5² = 50) → jamais atteint (uranium n'a que 21 électrons en O)
Couche P (n=6) : maximum 72 électrons (2 × 6² = 72) → jamais atteint
Couche Q (n=7) : maximum 98 électrons (2 × 7² = 98) → jamais atteint
N.B. :
En pratique, aucun élément connu ne remplit complètement les couches au-delà de N. L'élément naturel le plus lourd, l'uranium (Z=92), possède la configuration K(2) L(8) M(18) N(32) O(21) P(9) Q(2). L'élément synthétique le plus lourd confirmé, l'oganesson (Z=118), a la configuration K(2) L(8) M(18) N(32) O(32) P(18) Q(8).
Chaque couche est divisée en sous-couches désignées par les lettres s, p, d, f :
Sous-couche s : peut contenir jusqu'à 2 électrons (1 orbitale)
Sous-couche p : peut contenir jusqu'à 6 électrons (3 orbitales)
Sous-couche d : peut contenir jusqu'à 10 électrons (5 orbitales)
Sous-couche f : peut contenir jusqu'à 14 électrons (7 orbitales)
Couche K (n=1) : contient uniquement 1s (2 électrons max)
Couche L (n=2) : contient 2s et 2p (2 + 6 = 8 électrons max)
Couche M (n=3) : contient 3s, 3p et 3d (2 + 6 + 10 = 18 électrons max)
Couche N (n=4) : contient 4s, 4p, 4d et 4f (2 + 6 + 10 + 14 = 32 électrons max)
Couche O (n=5) : contient 5s, 5p, 5d et 5f (2 + 6 + 10 + 14 = 32 électrons max théoriques, bien que la sous-couche 5g théorique n'existe pas dans les éléments connus)
Couche P (n=6) : contient 6s, 6p, 6d et 6f (2 + 6 + 10 + 14 = 32 électrons max pour les sous-couches connues)
Couche Q (n=7) : contient 7s, 7p et potentiellement 7d (seuls les électrons 7s et 7p sont observés dans les éléments connus)
Cette notation indique le nombre total d'électrons présents dans chaque couche, sans détailler les sous-couches. Elle est particulièrement utile pour visualiser rapidement la répartition électronique globale d'un atome.
Hélium (2 électrons) : 1s² → K(2)
La couche K est complète et saturée.
Néon (10 électrons) : 1s² 2s² 2p⁶ → K(2) L(8)
Les couches K et L sont complètes et saturées.
Sodium (11 électrons) : 1s² 2s² 2p⁶ 3s¹ → K(2) L(8) M(1)
Les couches K et L sont complètes, la couche M ne contient qu'1 électron sur 18 possibles.
Argon (18 électrons) : 1s² 2s² 2p⁶ 3s² 3p⁶ → K(2) L(8) M(8)
Les couches K et L sont complètes. La couche M contient 8 électrons mais n'est pas complète (les sous-couches 3s et 3p sont saturées, mais 3d reste vide).
Calcium (20 électrons) : 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² → K(2) L(8) M(8) N(2)
Notez que la sous-couche 4s se remplit avant la 3d, ce qui explique pourquoi la couche M reste à 8 électrons.
Titane (22 électrons) : 1s² 2s² 2p⁶ 3s² 3p⁶ 3d² 4s² → K(2) L(8) M(10) N(2)
La couche M commence à se remplir avec les électrons 3d.
L'ordre de remplissage ne suit pas strictement l'ordre des couches K, L, M, N… en raison des niveaux d'énergie des sous-couches. L'ordre général est :
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d…
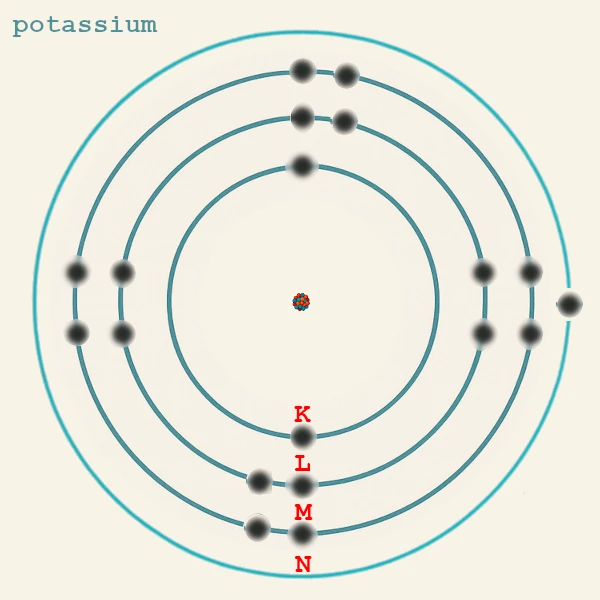
Ce principe explique pourquoi, par exemple, le potassium (19 électrons) a la configuration K(2) L(8) M(8) N(1) : l'électron 19 va dans 4s plutôt que 3d car la sous-couche 4s est de plus basse énergie que 3d.
La notation K, L, M, N, O, P, Q permet de :
• Visualiser rapidement la structure électronique globale d'un atome
• Identifier facilement la couche de valence (couche externe)
• Comprendre les propriétés chimiques liées aux électrons de valence
• Expliquer la classification des éléments dans le tableau périodique
• Prédire les états d'oxydation et la réactivité chimique des éléments
La réactivité chimique des éléments trouve son origine dans leur structure électronique, notamment dans la configuration de leur couche de valence. La couche externe, ou couche de valence, détermine la capacité d'un élément à former des liaisons chimiques : les atomes tendent à gagner, perdre ou partager des électrons pour atteindre une configuration stable, généralement celle du gaz noble le plus proche.
Cette tendance explique les affinités chimiques observées : les métaux alcalins, avec un seul électron de valence, le cèdent facilement pour former des cations ; les halogènes, auxquels il manque un électron pour compléter leur couche externe, sont avides d'électrons et forment des anions ; tandis que les gaz nobles, avec leur couche de valence complète, restent chimiquement inertes. Entre ces extrêmes, les éléments de transition et les métalloïdes présentent des comportements intermédiaires, pouvant former plusieurs types de liaisons selon les conditions.
La compréhension de ces relations structure-propriétés constitue le fondement de la chimie moderne et permet de prédire le comportement des éléments dans les réactions chimiques.
| Élément | Symbole (Z) | Couche de valence | Électrons de valence | Configuration de valence | Affinité avec d'autres éléments (exemples) |
|---|---|---|---|---|---|
| Hydrogène | H (Z = 1) | n = 1 | 1 | 1s¹ | Liaisons covalentes avec O (H₂O), C (CH₄), N (NH₃). |
| Hélium | He (Z = 2) | n = 1 | 2 | 1s² | Affinité chimique quasi nulle ; gaz noble inerte. |
| Lithium | Li (Z = 3) | n = 2 | 1 | 2s¹ | Liaisons ioniques avec F (LiF), O (Li₂O). |
| Béryllium | Be (Z = 4) | n = 2 | 2 | 2s² | Liaisons covalentes avec O (BeO), C (Be₂C). |
| Bore | B (Z = 5) | n = 2 | 3 | 2s² 2p¹ | Liaisons déficientes avec F (BF₃), H (boranes). |
| Carbone | C (Z = 6) | n = 2 | 4 | 2s² 2p² | Liaisons covalentes avec H, O (CO₂), N. |
| Azote | N (Z = 7) | n = 2 | 5 | 2s² 2p³ | Liaisons multiples avec H (NH₃), C (CN⁻). |
| Oxygène | O (Z = 8) | n = 2 | 6 | 2s² 2p⁴ | Oxydant majeur ; liaisons avec H, C, métaux. |
| Fluor | F (Z = 9) | n = 2 | 7 | 2s² 2p⁵ | Très forte électronégativité ; liaisons ioniques. |
| Néon | Ne (Z = 10) | n = 2 | 8 | 2s² 2p⁶ | Gaz noble chimiquement inerte. |
| Sodium | Na (Z = 11) | n = 3 | 1 | 3s¹ | Liaisons ioniques avec Cl (NaCl), O. |
| Magnésium | Mg (Z = 12) | n = 3 | 2 | 3s² | Liaisons ioniques avec O (MgO). |
| Aluminium | Al (Z = 13) | n = 3 | 3 | 3s² 3p¹ | Liaisons métalliques et covalentes (Al₂O₃). |
| Silicium | Si (Z = 14) | n = 3 | 4 | 3s² 3p² | Réseaux covalents (SiO₂). |
| Phosphore | P (Z = 15) | n = 3 | 5 | 3s² 3p³ | Liaisons avec O (PO₄³⁻), H. |
| Soufre | S (Z = 16) | n = 3 | 6 | 3s² 3p⁴ | Liaisons avec H (H₂S), O (SO₂). |
| Chlore | Cl (Z = 17) | n = 3 | 7 | 3s² 3p⁵ | Liaisons ioniques avec Na, covalentes avec H. |
| Argon | Ar (Z = 18) | n = 3 | 8 | 3s² 3p⁶ | Gaz noble inerte. |
| Potassium | K (Z = 19) | n = 4 | 1 | 4s¹ | Liaisons ioniques avec Cl (KCl), O. |
| Calcium | Ca (Z = 20) | n = 4 | 2 | 4s² | Liaisons ioniques avec O (CaO), carbonates. |
| Scandium | Sc (Z = 21) | n = 4 | 3 | 4s² 3d¹ | Liaisons métalliques ; oxydes Sc₂O₃. |
| Titane | Ti (Z = 22) | n = 4 | 4 | 4s² 3d² | Liaisons métalliques ; oxydes TiO₂. |
| Vanadium | V (Z = 23) | n = 4 | 5 | 4s² 3d³ | États d'oxydation multiples ; V₂O₅. |
| Chrome | Cr (Z = 24) | n = 4 | 6 | 4s¹ 3d⁵ | Liaisons métalliques ; oxydes Cr₂O₃. |
| Manganèse | Mn (Z = 25) | n = 4 | 7 | 4s² 3d⁵ | États d'oxydation variés ; MnO₂. |
| Fer | Fe (Z = 26) | n = 4 | 2–3 | 4s² 3d⁶ | Liaisons métalliques ; oxydes Fe₂O₃. |
| Cobalt | Co (Z = 27) | n = 4 | 2–3 | 4s² 3d⁷ | Liaisons métalliques ; complexes CoO. |
| Nickel | Ni (Z = 28) | n = 4 | 2 | 4s² 3d⁸ | Liaisons métalliques ; catalyseur NiO. |
| Cuivre | Cu (Z = 29) | n = 4 | 1–2 | 4s¹ 3d¹⁰ | Liaisons métalliques ; oxydes CuO. |
| Zinc | Zn (Z = 30) | n = 4 | 2 | 4s² 3d¹⁰ | Liaisons ioniques avec O, S. |
| Gallium | Ga (Z = 31) | n = 4 | 3 | 4s² 4p¹ | Liaisons métalliques ; semiconducteurs GaAs. |
| Germanium | Ge (Z = 32) | n = 4 | 4 | 4s² 4p² | Semiconducteur ; liaisons covalentes GeO₂. |
| Arsenic | As (Z = 33) | n = 4 | 5 | 4s² 4p³ | Liaisons covalentes avec S, O. |
| Sélénium | Se (Z = 34) | n = 4 | 6 | 4s² 4p⁴ | Analogue du soufre ; H₂Se. |
| Brome | Br (Z = 35) | n = 4 | 7 | 4s² 4p⁵ | Halogène ; liaisons avec H, métaux. |
| Krypton | Kr (Z = 36) | n = 4 | 8 | 4s² 4p⁶ | Gaz noble quasi inerte. |
| Rubidium | Rb (Z = 37) | n = 5 | 1 | 5s¹ | Métal alcalin ; liaisons ioniques RbCl. |
| Strontium | Sr (Z = 38) | n = 5 | 2 | 5s² | Liaisons ioniques avec O (SrO). |
| Yttrium | Y (Z = 39) | n = 5 | 3 | 5s² 4d¹ | Métal de transition ; Y₂O₃. |
| Zirconium | Zr (Z = 40) | n = 5 | 4 | 5s² 4d² | Liaisons métalliques ; ZrO₂. |
| Niobium | Nb (Z = 41) | n = 5 | 5 | 5s¹ 4d⁴ | Supraconducteur ; Nb₂O₅. |
| Molybdène | Mo (Z = 42) | n = 5 | 6 | 5s¹ 4d⁵ | Liaisons métalliques ; MoS₂. |
| Technétium | Tc (Z = 43) | n = 5 | 7 | 5s² 4d⁵ | Radioactif ; complexes avec O. |
| Ruthénium | Ru (Z = 44) | n = 5 | 8 | 5s¹ 4d⁷ | Catalyseur ; RuO₂. |
| Rhodium | Rh (Z = 45) | n = 5 | 9 | 5s¹ 4d⁸ | Catalyseur ; Rh₂O₃. |
| Palladium | Pd (Z = 46) | n = 5 | 10 | 4d¹⁰ | Catalyseur ; PdO. |
| Argent | Ag (Z = 47) | n = 5 | 1 | 5s¹ 4d¹⁰ | Liaisons métalliques ; Ag₂O. |
| Cadmium | Cd (Z = 48) | n = 5 | 2 | 5s² 4d¹⁰ | Liaisons ioniques ; CdS. |
| Indium | In (Z = 49) | n = 5 | 3 | 5s² 5p¹ | Semiconducteur ; In₂O₃. |
| Étain | Sn (Z = 50) | n = 5 | 4 | 5s² 5p² | Liaisons métalliques ; SnO₂. |
| Antimoine | Sb (Z = 51) | n = 5 | 5 | 5s² 5p³ | Semi-métal ; Sb₂O₃. |
| Tellure | Te (Z = 52) | n = 5 | 6 | 5s² 5p⁴ | Semi-métal ; H₂Te. |
| Iode | I (Z = 53) | n = 5 | 7 | 5s² 5p⁵ | Halogène ; liaisons avec H, métaux. |
| Xénon | Xe (Z = 54) | n = 5 | 8 | 5s² 5p⁶ | Gaz noble ; composés avec F (XeF₄). |
| Césium | Cs (Z = 55) | n = 6 | 1 | 6s¹ | Métal alcalin très réactif ; CsCl. |
| Baryum | Ba (Z = 56) | n = 6 | 2 | 6s² | Liaisons ioniques ; BaO. |
| Lanthane | La (Z = 57) | n = 6 | 3 | 6s² 5d¹ | Lanthanide ; La₂O₃. |
| Cérium | Ce (Z = 58) | n = 6 | 3–4 | 6s² 4f¹ 5d¹ | Lanthanide ; CeO₂. |
| Praséodyme | Pr (Z = 59) | n = 6 | 3 | 6s² 4f³ | Lanthanide ; Pr₂O₃. |
| Néodyme | Nd (Z = 60) | n = 6 | 3 | 6s² 4f⁴ | Aimants puissants ; Nd₂O₃. |
| Prométhium | Pm (Z = 61) | n = 6 | 3 | 6s² 4f⁵ | Radioactif ; Pm₂O₃. |
| Samarium | Sm (Z = 62) | n = 6 | 2–3 | 6s² 4f⁶ | Aimants ; Sm₂O₃. |
| Europium | Eu (Z = 63) | n = 6 | 2–3 | 6s² 4f⁷ | Luminophore ; Eu₂O₃. |
| Gadolinium | Gd (Z = 64) | n = 6 | 3 | 6s² 4f⁷ 5d¹ | Magnétique ; Gd₂O₃. |
| Terbium | Tb (Z = 65) | n = 6 | 3 | 6s² 4f⁹ | Luminophore ; Tb₂O₃. |
| Dysprosium | Dy (Z = 66) | n = 6 | 3 | 6s² 4f¹⁰ | Aimants ; Dy₂O₃. |
| Holmium | Ho (Z = 67) | n = 6 | 3 | 6s² 4f¹¹ | Magnétique ; Ho₂O₃. |
| Erbium | Er (Z = 68) | n = 6 | 3 | 6s² 4f¹² | Optique ; Er₂O₃. |
| Thulium | Tm (Z = 69) | n = 6 | 3 | 6s² 4f¹³ | Lasers ; Tm₂O₃. |
| Ytterbium | Yb (Z = 70) | n = 6 | 2–3 | 6s² 4f¹⁴ | Yb₂O₃. |
| Lutécium | Lu (Z = 71) | n = 6 | 3 | 6s² 4f¹⁴ 5d¹ | Lu₂O₃. |
| Hafnium | Hf (Z = 72) | n = 6 | 4 | 6s² 4f¹⁴ 5d² | Liaisons métalliques ; HfO₂. |
| Tantale | Ta (Z = 73) | n = 6 | 5 | 6s² 4f¹⁴ 5d³ | Résistant ; Ta₂O₅. |
| Tungstène | W (Z = 74) | n = 6 | 6 | 6s² 4f¹⁴ 5d⁴ | Point de fusion élevé ; WO₃. |
| Rhénium | Re (Z = 75) | n = 6 | 7 | 6s² 4f¹⁴ 5d⁵ | Catalyseur ; Re₂O₇. |
| Osmium | Os (Z = 76) | n = 6 | 8 | 6s² 4f¹⁴ 5d⁶ | Très dense ; OsO₄. |
| Iridium | Ir (Z = 77) | n = 6 | 9 | 6s² 4f¹⁴ 5d⁷ | Résistant ; IrO₂. |
| Platine | Pt (Z = 78) | n = 6 | 10 | 6s¹ 4f¹⁴ 5d⁹ | Catalyseur ; PtO₂. |
| Or | Au (Z = 79) | n = 6 | 1 | 6s¹ 4f¹⁴ 5d¹⁰ | Noble ; Au₂O₃. |
| Mercure | Hg (Z = 80) | n = 6 | 2 | 6s² 4f¹⁴ 5d¹⁰ | Liquide ; HgO. |
| Thallium | Tl (Z = 81) | n = 6 | 3 | 6s² 6p¹ | Toxique ; Tl₂O. |
| Plomb | Pb (Z = 82) | n = 6 | 4 | 6s² 6p² | Liaisons métalliques ; PbO. |
| Bismuth | Bi (Z = 83) | n = 6 | 5 | 6s² 6p³ | Semi-métal ; Bi₂O₃. |
| Polonium | Po (Z = 84) | n = 6 | 6 | 6s² 6p⁴ | Radioactif ; PoO₂. |
| Astate | At (Z = 85) | n = 6 | 7 | 6s² 6p⁵ | Radioactif ; halogène rare. |
| Radon | Rn (Z = 86) | n = 6 | 8 | 6s² 6p⁶ | Gaz noble radioactif. |
| Francium | Fr (Z = 87) | n = 7 | 1 | 7s¹ | Radioactif ; métal alcalin. |
| Radium | Ra (Z = 88) | n = 7 | 2 | 7s² | Radioactif ; RaO. |
| Actinium | Ac (Z = 89) | n = 7 | 3 | 7s² 6d¹ | Actinide ; Ac₂O₃. |
| Thorium | Th (Z = 90) | n = 7 | 4 | 7s² 6d² | Actinide ; ThO₂. |
| Protactinium | Pa (Z = 91) | n = 7 | 5 | 7s² 5f² 6d¹ | Radioactif ; Pa₂O₅. |
| Uranium | U (Z = 92) | n = 7 | 3–6 | 7s² 6d¹ 5f³ | Liaisons complexes avec O (UO₂²⁺), F (UF₆). |