原子核の周りの電子の配置を説明するために、物理学者は単純な歴史的表記法を使用します:電子殻K、L、M、N、O、P、Q。 この表記法は、20世紀初頭に物理学者のチャールズ・バークラ(1877-1944)によってX線の研究中に導入されました。 この表記法により、電子がエネルギーレベルの増加に従って、核に最も近い殻(K)から外側の殻までどのように分布するかを簡単に視覚化できます。
各文字は主量子数nに対応します:
K殻:n = 1(第一殻、核に最も近い)
L殻:n = 2(第二殻)
M殻:n = 3(第三殻)
N殻:n = 4(第四殻)
O殻:n = 5(第五殻)
P殻:n = 6(第六殻)
Q殻:n = 7(第七殻)
各殻は、2n²の公式で定義される最大電子数を収容できます:
K殻 (n=1):最大2個の電子(2 × 1² = 2)
L殻 (n=2):最大8個の電子(2 × 2² = 8)
M殻 (n=3):最大18個の電子(2 × 3² = 18)
N殻 (n=4):最大32個の電子(2 × 4² = 32)→ ウランが達成:K(2) L(8) M(18) N(32)
O殻 (n=5):最大50個の電子(2 × 5² = 50)→ 達成されていない(ウランはO殻に21個の電子しか持たない)
P殻 (n=6):最大72個の電子(2 × 6² = 72)→ 達成されていない
Q殻 (n=7):最大98個の電子(2 × 7² = 98)→ 達成されていない
注:
実際には、既知の元素でNを超える殻が完全に満たされることはありません。最も重い天然元素であるウラン(Z=92)の電子配置はK(2) L(8) M(18) N(32) O(21) P(9) Q(2)です。最も重い確認済みの合成元素であるオガネソン(Z=118)の電子配置はK(2) L(8) M(18) N(32) O(32) P(18) Q(8)です。
各殻は、s、p、d、fの文字で指定される副殻に分かれています:
s副殻:最大2個の電子(1軌道)
p副殻:最大6個の電子(3軌道)
d副殻:最大10個の電子(5軌道)
f副殻:最大14個の電子(7軌道)
K殻 (n=1):1sのみを含む(最大2個の電子)
L殻 (n=2):2sと2pを含む(2 + 6 = 最大8個の電子)
M殻 (n=3):3s、3p、3dを含む(2 + 6 + 10 = 最大18個の電子)
N殻 (n=4):4s、4p、4d、4fを含む(2 + 6 + 10 + 14 = 最大32個の電子)
O殻 (n=5):5s、5p、5d、5fを含む(2 + 6 + 10 + 14 = 理論上の最大32個の電子、ただし既知の元素には理論的な5g副殻は存在しない)
P殻 (n=6):6s、6p、6d、6fを含む(2 + 6 + 10 + 14 = 既知の副殻の最大32個の電子)
Q殻 (n=7):7s、7p、および潜在的に7dを含む(既知の元素では7sと7pの電子のみが観察される)
この表記法は、各殻に存在する電子の総数を示し、副殻の詳細は示しません。原子の全体的な電子分布を迅速に視覚化するのに特に役立ちます。
ヘリウム(2個の電子):1s² → K(2)
K殻は完全で飽和しています。
ネオン(10個の電子):1s² 2s² 2p⁶ → K(2) L(8)
K殻とL殻は完全で飽和しています。
ナトリウム(11個の電子):1s² 2s² 2p⁶ 3s¹ → K(2) L(8) M(1)
K殻とL殻は完全で、M殻には18個可能な電子のうち1個しか含まれていません。
アルゴン(18個の電子):1s² 2s² 2p⁶ 3s² 3p⁶ → K(2) L(8) M(8)
K殻とL殻は完全です。M殻には8個の電子が含まれていますが、完全ではありません(3sと3pの副殻は飽和していますが、3dは空のままです)。
カルシウム(20個の電子):1s² 2s² 2p⁶ 3s² 3p⁶ 4s² → K(2) L(8) M(8) N(2)
3dよりも先に4sの副殻が満たされるため、M殻は8個の電子のままです。
チタン(22個の電子):1s² 2s² 2p⁶ 3s² 3p⁶ 3d² 4s² → K(2) L(8) M(10) N(2)
M殻は3d電子で満たされ始めます。
充填順序は、副殻のエネルギーレベルのために、K、L、M、N殻の順序に厳密には従いません。一般的な順序は次の通りです:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d…
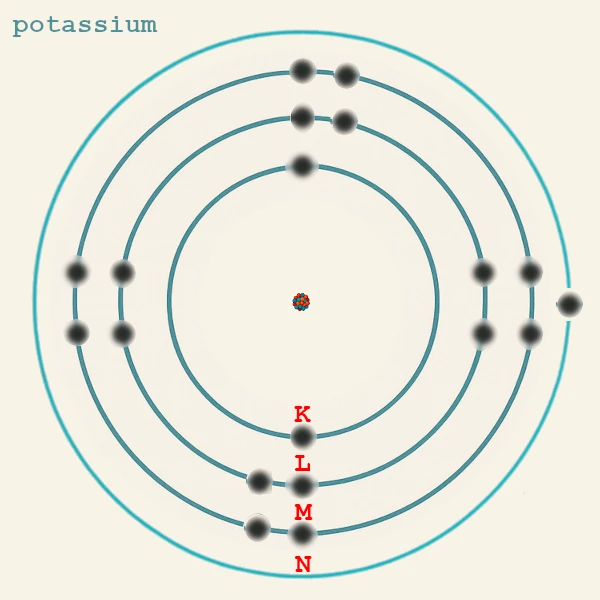
この原理は、例えばカリウム(19個の電子)がK(2) L(8) M(8) N(1)の配置を持つ理由を説明します:19番目の電子は3dではなく4sに入ります。なぜなら、4s副殻は3dよりもエネルギーが低いからです。
K、L、M、N、O、P、Qの表記法により:
• 原子の全体的な電子構造を迅速に視覚化できる
• 最外殻(価電子殻)を簡単に識別できる
• 価電子に関連する化学的性質を理解できる
• 周期表における元素の分類を説明できる
• 元素の酸化状態と化学的反応性を予測できる
元素の化学反応性は、その電子構造、特に最外殻電子の配置に由来します。 最外殻、または価電子殻は、元素が化学結合を形成する能力を決定します:原子は、通常、最も近い希ガスの電子配置を達成するために、電子を得たり、失ったり、共有したりします。
この傾向は、観察される化学的親和性を説明します:アルカリ金属は、1つの価電子を容易に放出してカチオンを形成します;ハロゲンは、最外殻を完成させるために1つの電子が不足しており、電子を求めてアニオンを形成します;一方、希ガスは価電子殻が完全であるため、化学的に不活性です。これらの極端の間に、遷移元素と半金属は中間的な挙動を示し、条件に応じてさまざまな種類の結合を形成します。
これらの構造-性質関係の理解は、現代化学の基礎をなし、化学反応における元素の挙動を予測することを可能にします。
| 元素 | 記号 (Z) | 価電子殻 | 価電子 | 価電子配置 | 他の元素との親和性(例) |
|---|---|---|---|---|---|
| 水素 | H (Z = 1) | n = 1 | 1 | 1s¹ | O (H₂O)、C (CH₄)、N (NH₃) との共有結合。 |
| ヘリウム | He (Z = 2) | n = 1 | 2 | 1s² | 化学的親和性はほとんどない;不活性な希ガス。 |
| リチウム | Li (Z = 3) | n = 2 | 1 | 2s¹ | F (LiF)、O (Li₂O) とのイオン結合。 |
| ベリリウム | Be (Z = 4) | n = 2 | 2 | 2s² | O (BeO)、C (Be₂C) との共有結合。 |
| ホウ素 | B (Z = 5) | n = 2 | 3 | 2s² 2p¹ | F (BF₃)、H (ボラン) との不足結合。 |
| 炭素 | C (Z = 6) | n = 2 | 4 | 2s² 2p² | H、O (CO₂)、N との共有結合。 |
| 窒素 | N (Z = 7) | n = 2 | 5 | 2s² 2p³ | H (NH₃)、C (CN⁻) との多重結合。 |
| 酸素 | O (Z = 8) | n = 2 | 6 | 2s² 2p⁴ | 主要な酸化剤;H、C、金属との結合。 |
| フッ素 | F (Z = 9) | n = 2 | 7 | 2s² 2p⁵ | 非常に高い電気陰性度;イオン結合。 |
| ネオン | Ne (Z = 10) | n = 2 | 8 | 2s² 2p⁶ | 不活性な希ガス。 |
| ナトリウム | Na (Z = 11) | n = 3 | 1 | 3s¹ | Cl (NaCl)、O とのイオン結合。 |
| マグネシウム | Mg (Z = 12) | n = 3 | 2 | 3s² | O (MgO) とのイオン結合。 |
| アルミニウム | Al (Z = 13) | n = 3 | 3 | 3s² 3p¹ | 金属結合および共有結合 (Al₂O₃)。 |
| ケイ素 | Si (Z = 14) | n = 3 | 4 | 3s² 3p² | 共有結合ネットワーク (SiO₂)。 |
| リン | P (Z = 15) | n = 3 | 5 | 3s² 3p³ | O (PO₄³⁻)、H との結合。 |
| 硫黄 | S (Z = 16) | n = 3 | 6 | 3s² 3p⁴ | H (H₂S)、O (SO₂) との結合。 |
| 塩素 | Cl (Z = 17) | n = 3 | 7 | 3s² 3p⁵ | Na とのイオン結合、H との共有結合。 |
| アルゴン | Ar (Z = 18) | n = 3 | 8 | 3s² 3p⁶ | 不活性な希ガス。 |
| カリウム | K (Z = 19) | n = 4 | 1 | 4s¹ | Cl (KCl)、O とのイオン結合。 |
| カルシウム | Ca (Z = 20) | n = 4 | 2 | 4s² | O (CaO)、炭酸塩とのイオン結合。 |
| スカンジウム | Sc (Z = 21) | n = 4 | 3 | 4s² 3d¹ | 金属結合;酸化物 Sc₂O₃。 |
| チタン | Ti (Z = 22) | n = 4 | 4 | 4s² 3d² | 金属結合;酸化物 TiO₂。 |
| バナジウム | V (Z = 23) | n = 4 | 5 | 4s² 3d³ | 複数の酸化状態;V₂O₅。 |
| クロム | Cr (Z = 24) | n = 4 | 6 | 4s¹ 3d⁵ | 金属結合;酸化物 Cr₂O₃。 |
| マンガン | Mn (Z = 25) | n = 4 | 7 | 4s² 3d⁵ | 様々な酸化状態;MnO₂。 |
| 鉄 | Fe (Z = 26) | n = 4 | 2–3 | 4s² 3d⁶ | 金属結合;酸化物 Fe₂O₃。 |
| コバルト | Co (Z = 27) | n = 4 | 2–3 | 4s² 3d⁷ | 金属結合;錯体 CoO。 |
| ニッケル | Ni (Z = 28) | n = 4 | 2 | 4s² 3d⁸ | 金属結合;触媒 NiO。 |
| 銅 | Cu (Z = 29) | n = 4 | 1–2 | 4s¹ 3d¹⁰ | 金属結合;酸化物 CuO。 |
| 亜鉛 | Zn (Z = 30) | n = 4 | 2 | 4s² 3d¹⁰ | O、S とのイオン結合。 |
| ガリウム | Ga (Z = 31) | n = 4 | 3 | 4s² 4p¹ | 金属結合;半導体 GaAs。 |
| ゲルマニウム | Ge (Z = 32) | n = 4 | 4 | 4s² 4p² | 半導体;共有結合 GeO₂。 |
| ヒ素 | As (Z = 33) | n = 4 | 5 | 4s² 4p³ | S、O との共有結合。 |
| セレン | Se (Z = 34) | n = 4 | 6 | 4s² 4p⁴ | 硫黄の類似体;H₂Se。 |
| 臭素 | Br (Z = 35) | n = 4 | 7 | 4s² 4p⁵ | ハロゲン;H、金属との結合。 |
| クリプトン | Kr (Z = 36) | n = 4 | 8 | 4s² 4p⁶ | ほぼ不活性な希ガス。 |
| ルビジウム | Rb (Z = 37) | n = 5 | 1 | 5s¹ | アルカリ金属;イオン結合 RbCl。 |
| ストロンチウム | Sr (Z = 38) | n = 5 | 2 | 5s² | O (SrO) とのイオン結合。 |
| イットリウム | Y (Z = 39) | n = 5 | 3 | 5s² 4d¹ | 遷移金属;Y₂O₃。 |
| ジルコニウム | Zr (Z = 40) | n = 5 | 4 | 5s² 4d² | 金属結合;ZrO₂。 |
| ニオブ | Nb (Z = 41) | n = 5 | 5 | 5s¹ 4d⁴ | 超伝導体;Nb₂O₅。 |
| モリブデン | Mo (Z = 42) | n = 5 | 6 | 5s¹ 4d⁵ | 金属結合;MoS₂。 |
| テクネチウム | Tc (Z = 43) | n = 5 | 7 | 5s² 4d⁵ | 放射性;O との錯体。 |
| ルテニウム | Ru (Z = 44) | n = 5 | 8 | 5s¹ 4d⁷ | 触媒;RuO₂。 |
| ロジウム | Rh (Z = 45) | n = 5 | 9 | 5s¹ 4d⁸ | 触媒;Rh₂O₃。 |
| パラジウム | Pd (Z = 46) | n = 5 | 10 | 4d¹⁰ | 触媒;PdO。 |
| 銀 | Ag (Z = 47) | n = 5 | 1 | 5s¹ 4d¹⁰ | 金属結合;Ag₂O。 |
| カドミウム | Cd (Z = 48) | n = 5 | 2 | 5s² 4d¹⁰ | イオン結合;CdS。 |
| インジウム | In (Z = 49) | n = 5 | 3 | 5s² 5p¹ | 半導体;In₂O₃。 |
| スズ | Sn (Z = 50) | n = 5 | 4 | 5s² 5p² | 金属結合;SnO₂。 |
| アンチモン | Sb (Z = 51) | n = 5 | 5 | 5s² 5p³ | 半金属;Sb₂O₃。 |
| テルル | Te (Z = 52) | n = 5 | 6 | 5s² 5p⁴ | 半金属;H₂Te。 |
| ヨウ素 | I (Z = 53) | n = 5 | 7 | 5s² 5p⁵ | ハロゲン;H、金属との結合。 |
| キセノン | Xe (Z = 54) | n = 5 | 8 | 5s² 5p⁶ | 希ガス;F (XeF₄) との化合物。 |
| セシウム | Cs (Z = 55) | n = 6 | 1 | 6s¹ | 非常に反応性の高いアルカリ金属;CsCl。 |
| バリウム | Ba (Z = 56) | n = 6 | 2 | 6s² | イオン結合;BaO。 |
| ランタン | La (Z = 57) | n = 6 | 3 | 6s² 5d¹ | ランタノイド;La₂O₃。 |
| セリウム | Ce (Z = 58) | n = 6 | 3–4 | 6s² 4f¹ 5d¹ | ランタノイド;CeO₂。 |
| プラセオジム | Pr (Z = 59) | n = 6 | 3 | 6s² 4f³ | ランタノイド;Pr₂O₃。 |
| ネオジム | Nd (Z = 60) | n = 6 | 3 | 6s² 4f⁴ | 強力な磁石;Nd₂O₃。 |
| プロメチウム | Pm (Z = 61) | n = 6 | 3 | 6s² 4f⁵ | 放射性;Pm₂O₃。 |
| サマリウム | Sm (Z = 62) | n = 6 | 2–3 | 6s² 4f⁶ | 磁石;Sm₂O₃。 |
| ユウロピウム | Eu (Z = 63) | n = 6 | 2–3 | 6s² 4f⁷ | 蛍光体;Eu₂O₃。 |
| ガドリニウム | Gd (Z = 64) | n = 6 | 3 | 6s² 4f⁷ 5d¹ | 磁性;Gd₂O₃。 |
| テルビウム | Tb (Z = 65) | n = 6 | 3 | 6s² 4f⁹ | 蛍光体;Tb₂O₃。 |
| ジスプロシウム | Dy (Z = 66) | n = 6 | 3 | 6s² 4f¹⁰ | 磁石;Dy₂O₃。 |
| ホルミウム | Ho (Z = 67) | n = 6 | 3 | 6s² 4f¹¹ | 磁性;Ho₂O₃。 |
| エルビウム | Er (Z = 68) | n = 6 | 3 | 6s² 4f¹² | 光学;Er₂O₃。 |
| ツリウム | Tm (Z = 69) | n = 6 | 3 | 6s² 4f¹³ | レーザー;Tm₂O₃。 |
| イッテルビウム | Yb (Z = 70) | n = 6 | 2–3 | 6s² 4f¹⁴ | Yb₂O₃。 |
| ルテチウム | Lu (Z = 71) | n = 6 | 3 | 6s² 4f¹⁴ 5d¹ | Lu₂O₃。 |
| ハフニウム | Hf (Z = 72) | n = 6 | 4 | 6s² 4f¹⁴ 5d² | 金属結合;HfO₂。 |
| タンタル | Ta (Z = 73) | n = 6 | 5 | 6s² 4f¹⁴ 5d³ | 耐性;Ta₂O₅。 |
| タングステン | W (Z = 74) | n = 6 | 6 | 6s² 4f¹⁴ 5d⁴ | 高融点;WO₃。 |
| レニウム | Re (Z = 75) | n = 6 | 7 | 6s² 4f¹⁴ 5d⁵ | 触媒;Re₂O₇。 |
| オスミウム | Os (Z = 76) | n = 6 | 8 | 6s² 4f¹⁴ 5d⁶ | 非常に高密度;OsO₄。 |
| イリジウム | Ir (Z = 77) | n = 6 | 9 | 6s² 4f¹⁴ 5d⁷ | 耐性;IrO₂。 |
| 白金 | Pt (Z = 78) | n = 6 | 10 | 6s¹ 4f¹⁴ 5d⁹ | 触媒;PtO₂。 |
| 金 | Au (Z = 79) | n = 6 | 1 | 6s¹ 4f¹⁴ 5d¹⁰ | 貴金属;Au₂O₃。 |
| 水銀 | Hg (Z = 80) | n = 6 | 2 | 6s² 4f¹⁴ 5d¹⁰ | 液体;HgO。 |
| タリウム | Tl (Z = 81) | n = 6 | 3 | 6s² 6p¹ | 有毒;Tl₂O。 |
| 鉛 | Pb (Z = 82) | n = 6 | 4 | 6s² 6p² | 金属結合;PbO。 |
| ビスマス | Bi (Z = 83) | n = 6 | 5 | 6s² 6p³ | 半金属;Bi₂O₃。 |
| ポロニウム | Po (Z = 84) | n = 6 | 6 | 6s² 6p⁴ | 放射性;PoO₂。 |
| アスタチン | At (Z = 85) | n = 6 | 7 | 6s² 6p⁵ | 放射性;希少ハロゲン。 |
| ラドン | Rn (Z = 86) | n = 6 | 8 | 6s² 6p⁶ | 放射性希ガス。 |
| フランシウム | Fr (Z = 87) | n = 7 | 1 | 7s¹ | 放射性;アルカリ金属。 |
| ラジウム | Ra (Z = 88) | n = 7 | 2 | 7s² | 放射性;RaO。 |
| アクチニウム | Ac (Z = 89) | n = 7 | 3 | 7s² 6d¹ | アクチノイド;Ac₂O₃。 |
| トリウム | Th (Z = 90) | n = 7 | 4 | 7s² 6d² | アクチノイド;ThO₂。 |
| プロトアクチニウム | Pa (Z = 91) | n = 7 | 5 | 7s² 5f² 6d¹ | 放射性;Pa₂O₅。 |
| ウラン | U (Z = 92) | n = 7 | 3–6 | 7s² 6d¹ 5f³ | O (UO₂²⁺)、F (UF₆) との複雑な結合。 |