Para descrever a distribuição dos elétrons ao redor do núcleo atômico, os físicos usam uma notação histórica simples: as camadas eletrônicas K, L, M, N, O, P e Q. Esta notação foi introduzida no início do século XX pelo físico Charles Barkla (1877-1944) durante o estudo dos raios X. Esta notação permite visualizar rapidamente como os elétrons são distribuídos por níveis de energia crescentes, desde a camada mais próxima do núcleo (K) até as camadas externas.
Cada letra corresponde a um número quântico principal n:
Camada K: n = 1 (primeira camada, mais próxima do núcleo)
Camada L: n = 2 (segunda camada)
Camada M: n = 3 (terceira camada)
Camada N: n = 4 (quarta camada)
Camada O: n = 5 (quinta camada)
Camada P: n = 6 (sexta camada)
Camada Q: n = 7 (sétima camada)
Cada camada pode conter um número máximo de elétrons definido pela fórmula 2n²:
Camada K (n=1): máximo 2 elétrons (2 × 1² = 2)
Camada L (n=2): máximo 8 elétrons (2 × 2² = 8)
Camada M (n=3): máximo 18 elétrons (2 × 3² = 18)
Camada N (n=4): máximo 32 elétrons (2 × 4² = 32) → O urânio atinge isso: K(2) L(8) M(18) N(32)
Camada O (n=5): máximo 50 elétrons (2 × 5² = 50) → Nunca atingido (o urânio tem apenas 21 elétrons em O)
Camada P (n=6): máximo 72 elétrons (2 × 6² = 72) → Nunca atingido
Camada Q (n=7): máximo 98 elétrons (2 × 7² = 98) → Nunca atingido
N.B.:
Na prática, nenhum elemento conhecido preenche completamente as camadas além de N. O elemento natural mais pesado, o urânio (Z=92), possui a configuração K(2) L(8) M(18) N(32) O(21) P(9) Q(2). O elemento sintético mais pesado confirmado, o oganessônio (Z=118), tem a configuração K(2) L(8) M(18) N(32) O(32) P(18) Q(8).
Cada camada é dividida em subcamadas designadas pelas letras s, p, d, f:
Subcamada s: pode conter até 2 elétrons (1 orbital)
Subcamada p: pode conter até 6 elétrons (3 orbitais)
Subcamada d: pode conter até 10 elétrons (5 orbitais)
Subcamada f: pode conter até 14 elétrons (7 orbitais)
Camada K (n=1): contém apenas 1s (2 elétrons máx.)
Camada L (n=2): contém 2s e 2p (2 + 6 = 8 elétrons máx.)
Camada M (n=3): contém 3s, 3p e 3d (2 + 6 + 10 = 18 elétrons máx.)
Camada N (n=4): contém 4s, 4p, 4d e 4f (2 + 6 + 10 + 14 = 32 elétrons máx.)
Camada O (n=5): contém 5s, 5p, 5d e 5f (2 + 6 + 10 + 14 = 32 elétrons máx. teóricos, embora a subcamada 5g teórica não exista nos elementos conhecidos)
Camada P (n=6): contém 6s, 6p, 6d e 6f (2 + 6 + 10 + 14 = 32 elétrons máx. para as subcamadas conhecidas)
Camada Q (n=7): contém 7s, 7p e potencialmente 7d (apenas elétrons 7s e 7p são observados nos elementos conhecidos)
Esta notação indica o número total de elétrons presentes em cada camada, sem detalhar as subcamadas. É particularmente útil para visualizar rapidamente a distribuição eletrônica global de um átomo.
Hélio (2 elétrons): 1s² → K(2)
A camada K está completa e saturada.
Neônio (10 elétrons): 1s² 2s² 2p⁶ → K(2) L(8)
As camadas K e L estão completas e saturadas.
Sódio (11 elétrons): 1s² 2s² 2p⁶ 3s¹ → K(2) L(8) M(1)
As camadas K e L estão completas, a camada M contém apenas 1 elétron de 18 possíveis.
Argônio (18 elétrons): 1s² 2s² 2p⁶ 3s² 3p⁶ → K(2) L(8) M(8)
As camadas K e L estão completas. A camada M contém 8 elétrons, mas não está completa (as subcamadas 3s e 3p estão saturadas, mas 3d permanece vazia).
Cálcio (20 elétrons): 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² → K(2) L(8) M(8) N(2)
Note que a subcamada 4s é preenchida antes da 3d, o que explica por que a camada M permanece com 8 elétrons.
Titânio (22 elétrons): 1s² 2s² 2p⁶ 3s² 3p⁶ 3d² 4s² → K(2) L(8) M(10) N(2)
A camada M começa a ser preenchida com os elétrons 3d.
A ordem de preenchimento não segue estritamente a ordem das camadas K, L, M, N… devido aos níveis de energia das subcamadas. A ordem geral é:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d…
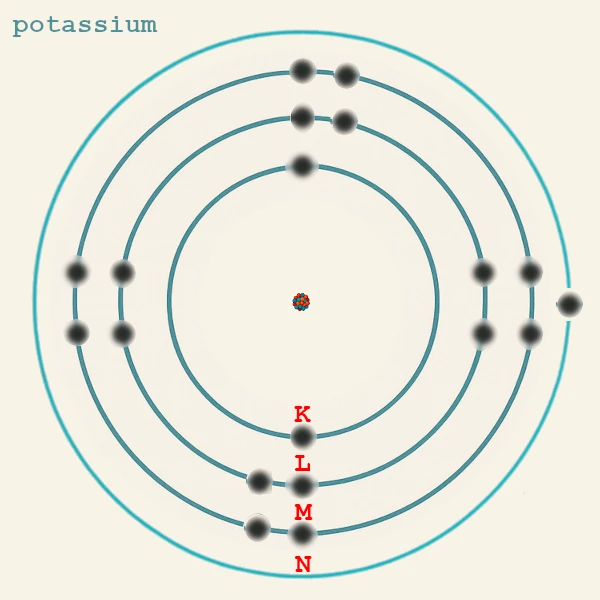
Este princípio explica por que, por exemplo, o potássio (19 elétrons) tem a configuração K(2) L(8) M(8) N(1): o 19º elétron vai para 4s em vez de 3d porque a subcamada 4s tem energia mais baixa que 3d.
A notação K, L, M, N, O, P, Q permite:
• Visualizar rapidamente a estrutura eletrônica global de um átomo
• Identificar facilmente a camada de valência (camada externa)
• Compreender as propriedades químicas relacionadas aos elétrons de valência
• Explicar a classificação dos elementos na tabela periódica
• Prever os estados de oxidação e a reatividade química dos elementos
A reatividade química dos elementos tem sua origem em sua estrutura eletrônica, especialmente na configuração de sua camada de valência. A camada externa, ou camada de valência, determina a capacidade de um elemento de formar ligações químicas: os átomos tendem a ganhar, perder ou compartilhar elétrons para atingir uma configuração estável, geralmente a do gás nobre mais próximo.
Essa tendência explica as afinidades químicas observadas: os metais alcalinos, com um único elétron de valência, o cedem facilmente para formar cátions; os halogênios, aos quais falta um elétron para completar sua camada externa, são ávidos por elétrons e formam ânions; enquanto os gases nobres, com sua camada de valência completa, permanecem quimicamente inertes. Entre esses extremos, os elementos de transição e os metaloides apresentam comportamentos intermediários, podendo formar vários tipos de ligações dependendo das condições.
A compreensão dessas relações estrutura-propriedade constitui a base da química moderna e permite prever o comportamento dos elementos em reações químicas.
| Elemento | Símbolo (Z) | Camada de valência | Elétrons de valência | Configuração de valência | Afinidade com outros elementos (exemplos) |
|---|---|---|---|---|---|
| Hidrogênio | H (Z = 1) | n = 1 | 1 | 1s¹ | Ligações covalentes com O (H₂O), C (CH₄), N (NH₃). |
| Hélio | He (Z = 2) | n = 1 | 2 | 1s² | Afinidade química quase nula; gás nobre inerte. |
| Lítio | Li (Z = 3) | n = 2 | 1 | 2s¹ | Ligações iônicas com F (LiF), O (Li₂O). |
| Berílio | Be (Z = 4) | n = 2 | 2 | 2s² | Ligações covalentes com O (BeO), C (Be₂C). |
| Boro | B (Z = 5) | n = 2 | 3 | 2s² 2p¹ | Ligações deficientes com F (BF₃), H (boranos). |
| Carbono | C (Z = 6) | n = 2 | 4 | 2s² 2p² | Ligações covalentes com H, O (CO₂), N. |
| Nitrogênio | N (Z = 7) | n = 2 | 5 | 2s² 2p³ | Ligações múltiplas com H (NH₃), C (CN⁻). |
| Oxigênio | O (Z = 8) | n = 2 | 6 | 2s² 2p⁴ | Principal oxidante; ligações com H, C, metais. |
| Flúor | F (Z = 9) | n = 2 | 7 | 2s² 2p⁵ | Eletronegatividade muito alta; ligações iônicas. |
| Neônio | Ne (Z = 10) | n = 2 | 8 | 2s² 2p⁶ | Gás nobre inerte. |
| Sódio | Na (Z = 11) | n = 3 | 1 | 3s¹ | Ligações iônicas com Cl (NaCl), O. |
| Magnésio | Mg (Z = 12) | n = 3 | 2 | 3s² | Ligações iônicas com O (MgO). |
| Alumínio | Al (Z = 13) | n = 3 | 3 | 3s² 3p¹ | Ligações metálicas e covalentes (Al₂O₃). |
| Silício | Si (Z = 14) | n = 3 | 4 | 3s² 3p² | Redes covalentes (SiO₂). |
| Fósforo | P (Z = 15) | n = 3 | 5 | 3s² 3p³ | Ligações com O (PO₄³⁻), H. |
| Enxofre | S (Z = 16) | n = 3 | 6 | 3s² 3p⁴ | Ligações com H (H₂S), O (SO₂). |
| Cloro | Cl (Z = 17) | n = 3 | 7 | 3s² 3p⁵ | Ligações iônicas com Na, covalentes com H. |
| Argônio | Ar (Z = 18) | n = 3 | 8 | 3s² 3p⁶ | Gás nobre inerte. |
| Potássio | K (Z = 19) | n = 4 | 1 | 4s¹ | Ligações iônicas com Cl (KCl), O. |
| Cálcio | Ca (Z = 20) | n = 4 | 2 | 4s² | Ligações iônicas com O (CaO), carbonatos. |
| Escândio | Sc (Z = 21) | n = 4 | 3 | 4s² 3d¹ | Ligações metálicas; óxidos Sc₂O₃. |
| Titânio | Ti (Z = 22) | n = 4 | 4 | 4s² 3d² | Ligações metálicas; óxidos TiO₂. |
| Vanádio | V (Z = 23) | n = 4 | 5 | 4s² 3d³ | Estados de oxidação múltiplos; V₂O₅. |
| Cromo | Cr (Z = 24) | n = 4 | 6 | 4s¹ 3d⁵ | Ligações metálicas; óxidos Cr₂O₃. |
| Manganês | Mn (Z = 25) | n = 4 | 7 | 4s² 3d⁵ | Estados de oxidação variados; MnO₂. |
| Ferro | Fe (Z = 26) | n = 4 | 2–3 | 4s² 3d⁶ | Ligações metálicas; óxidos Fe₂O₃. |
| Cobalto | Co (Z = 27) | n = 4 | 2–3 | 4s² 3d⁷ | Ligações metálicas; complexos CoO. |
| Níquel | Ni (Z = 28) | n = 4 | 2 | 4s² 3d⁸ | Ligações metálicas; catalisador NiO. |
| Cobre | Cu (Z = 29) | n = 4 | 1–2 | 4s¹ 3d¹⁰ | Ligações metálicas; óxidos CuO. |
| Zinco | Zn (Z = 30) | n = 4 | 2 | 4s² 3d¹⁰ | Ligações iônicas com O, S. |
| Gálio | Ga (Z = 31) | n = 4 | 3 | 4s² 4p¹ | Ligações metálicas; semicondutores GaAs. |
| Germânio | Ge (Z = 32) | n = 4 | 4 | 4s² 4p² | Semicondutor; ligações covalentes GeO₂. |
| Arsênio | As (Z = 33) | n = 4 | 5 | 4s² 4p³ | Ligações covalentes com S, O. |
| Selênio | Se (Z = 34) | n = 4 | 6 | 4s² 4p⁴ | Análogo ao enxofre; H₂Se. |
| Bromo | Br (Z = 35) | n = 4 | 7 | 4s² 4p⁵ | Halogênio; ligações com H, metais. |
| Criptônio | Kr (Z = 36) | n = 4 | 8 | 4s² 4p⁶ | Gás nobre quase inerte. |
| Rubídio | Rb (Z = 37) | n = 5 | 1 | 5s¹ | Metal alcalino; ligações iônicas RbCl. |
| Estrôncio | Sr (Z = 38) | n = 5 | 2 | 5s² | Ligações iônicas com O (SrO). |
| Ítrio | Y (Z = 39) | n = 5 | 3 | 5s² 4d¹ | Metal de transição; Y₂O₃. |
| Zircônio | Zr (Z = 40) | n = 5 | 4 | 5s² 4d² | Ligações metálicas; ZrO₂. |
| Nióbio | Nb (Z = 41) | n = 5 | 5 | 5s¹ 4d⁴ | Supercondutor; Nb₂O₅. |
| Molibdênio | Mo (Z = 42) | n = 5 | 6 | 5s¹ 4d⁵ | Ligações metálicas; MoS₂. |
| Tecnécio | Tc (Z = 43) | n = 5 | 7 | 5s² 4d⁵ | Radioativo; complexos com O. |
| Rutênio | Ru (Z = 44) | n = 5 | 8 | 5s¹ 4d⁷ | Catalisador; RuO₂. |
| Ródio | Rh (Z = 45) | n = 5 | 9 | 5s¹ 4d⁸ | Catalisador; Rh₂O₃. |
| Paládio | Pd (Z = 46) | n = 5 | 10 | 4d¹⁰ | Catalisador; PdO. |
| Prata | Ag (Z = 47) | n = 5 | 1 | 5s¹ 4d¹⁰ | Ligações metálicas; Ag₂O. |
| Cádmio | Cd (Z = 48) | n = 5 | 2 | 5s² 4d¹⁰ | Ligações iônicas; CdS. |
| Índio | In (Z = 49) | n = 5 | 3 | 5s² 5p¹ | Semicondutor; In₂O₃. |
| Estanho | Sn (Z = 50) | n = 5 | 4 | 5s² 5p² | Ligações metálicas; SnO₂. |
| Antimônio | Sb (Z = 51) | n = 5 | 5 | 5s² 5p³ | Semimetal; Sb₂O₃. |
| Telúrio | Te (Z = 52) | n = 5 | 6 | 5s² 5p⁴ | Semimetal; H₂Te. |
| Iodo | I (Z = 53) | n = 5 | 7 | 5s² 5p⁵ | Halogênio; ligações com H, metais. |
| Xenônio | Xe (Z = 54) | n = 5 | 8 | 5s² 5p⁶ | Gás nobre; compostos com F (XeF₄). |
| Césio | Cs (Z = 55) | n = 6 | 1 | 6s¹ | Metal alcalino muito reativo; CsCl. |
| Bário | Ba (Z = 56) | n = 6 | 2 | 6s² | Ligações iônicas; BaO. |
| Lantânio | La (Z = 57) | n = 6 | 3 | 6s² 5d¹ | Lantanídeo; La₂O₃. |
| Cério | Ce (Z = 58) | n = 6 | 3–4 | 6s² 4f¹ 5d¹ | Lantanídeo; CeO₂. |
| Praseodímio | Pr (Z = 59) | n = 6 | 3 | 6s² 4f³ | Lantanídeo; Pr₂O₃. |
| Neodímio | Nd (Z = 60) | n = 6 | 3 | 6s² 4f⁴ | Ímãs potentes; Nd₂O₃. |
| Promécio | Pm (Z = 61) | n = 6 | 3 | 6s² 4f⁵ | Radioativo; Pm₂O₃. |
| Samário | Sm (Z = 62) | n = 6 | 2–3 | 6s² 4f⁶ | Ímãs; Sm₂O₃. |
| Európio | Eu (Z = 63) | n = 6 | 2–3 | 6s² 4f⁷ | Fosforescente; Eu₂O₃. |
| Gadolínio | Gd (Z = 64) | n = 6 | 3 | 6s² 4f⁷ 5d¹ | Magnético; Gd₂O₃. |
| Térbio | Tb (Z = 65) | n = 6 | 3 | 6s² 4f⁹ | Fosforescente; Tb₂O₃. |
| Disprósio | Dy (Z = 66) | n = 6 | 3 | 6s² 4f¹⁰ | Ímãs; Dy₂O₃. |
| Hólmio | Ho (Z = 67) | n = 6 | 3 | 6s² 4f¹¹ | Magnético; Ho₂O₃. |
| Érbio | Er (Z = 68) | n = 6 | 3 | 6s² 4f¹² | Óptica; Er₂O₃. |
| Túlio | Tm (Z = 69) | n = 6 | 3 | 6s² 4f¹³ | Lasers; Tm₂O₃. |
| Itérbio | Yb (Z = 70) | n = 6 | 2–3 | 6s² 4f¹⁴ | Yb₂O₃. |
| Lutécio | Lu (Z = 71) | n = 6 | 3 | 6s² 4f¹⁴ 5d¹ | Lu₂O₃. |
| Háfnio | Hf (Z = 72) | n = 6 | 4 | 6s² 4f¹⁴ 5d² | Ligações metálicas; HfO₂. |
| Tântalo | Ta (Z = 73) | n = 6 | 5 | 6s² 4f¹⁴ 5d³ | Resistente; Ta₂O₅. |
| Tungstênio | W (Z = 74) | n = 6 | 6 | 6s² 4f¹⁴ 5d⁴ | Ponto de fusão elevado; WO₃. |
| Rênio | Re (Z = 75) | n = 6 | 7 | 6s² 4f¹⁴ 5d⁵ | Catalisador; Re₂O₇. |
| Ósmio | Os (Z = 76) | n = 6 | 8 | 6s² 4f¹⁴ 5d⁶ | Muito denso; OsO₄. |
| Irídio | Ir (Z = 77) | n = 6 | 9 | 6s² 4f¹⁴ 5d⁷ | Resistente; IrO₂. |
| Platina | Pt (Z = 78) | n = 6 | 10 | 6s¹ 4f¹⁴ 5d⁹ | Catalisador; PtO₂. |
| Ouro | Au (Z = 79) | n = 6 | 1 | 6s¹ 4f¹⁴ 5d¹⁰ | Nobre; Au₂O₃. |
| Mercúrio | Hg (Z = 80) | n = 6 | 2 | 6s² 4f¹⁴ 5d¹⁰ | Líquido; HgO. |
| Tálio | Tl (Z = 81) | n = 6 | 3 | 6s² 6p¹ | Tóxico; Tl₂O. |
| Chumbo | Pb (Z = 82) | n = 6 | 4 | 6s² 6p² | Ligações metálicas; PbO. |
| Bismuto | Bi (Z = 83) | n = 6 | 5 | 6s² 6p³ | Semimetal; Bi₂O₃. |
| Polônio | Po (Z = 84) | n = 6 | 6 | 6s² 6p⁴ | Radioativo; PoO₂. |
| Astato | At (Z = 85) | n = 6 | 7 | 6s² 6p⁵ | Radioativo; halogênio raro. |
| Radônio | Rn (Z = 86) | n = 6 | 8 | 6s² 6p⁶ | Gás nobre radioativo. |
| Frâncio | Fr (Z = 87) | n = 7 | 1 | 7s¹ | Radioativo; metal alcalino. |
| Rádio | Ra (Z = 88) | n = 7 | 2 | 7s² | Radioativo; RaO. |
| Actínio | Ac (Z = 89) | n = 7 | 3 | 7s² 6d¹ | Actinídeo; Ac₂O₃. |
| Tório | Th (Z = 90) | n = 7 | 4 | 7s² 6d² | Actinídeo; ThO₂. |
| Protactínio | Pa (Z = 91) | n = 7 | 5 | 7s² 5f² 6d¹ | Radioativo; Pa₂O₅. |
| Urânio | U (Z = 92) | n = 7 | 3–6 | 7s² 6d¹ 5f³ | Ligações complexas com O (UO₂²⁺), F (UF₆). |