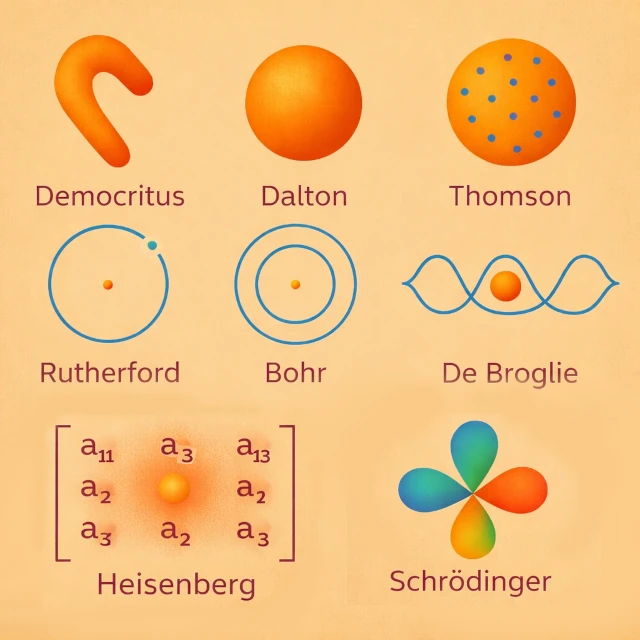
O conceito de átomo apareceu no século V a.C. com Demócrito (c. 460-370 a.C.), que postulou, através de uma abordagem essencialmente intuitiva e racional, a existência de partículas indivisíveis que se movem no vazio. Esta proposta não se baseava na observação experimental, mas numa intuição filosófica destinada a resolver o problema da divisibilidade infinita da matéria. Nenhum experimento permitia então testar esta hipótese. O átomo era assim concebido como a unidade última da matéria, sem estrutura interna nem propriedades mensuráveis. Para Demócrito, o átomo possuía uma forma própria que explicava intuitivamente as propriedades dos corpos: por exemplo, átomos com ganchos se encaixavam e davam texturas ásperas, enquanto átomos redondos ou lisos produziam substâncias fluidas ou macias.
Na Idade Média, não existia uma modelização física do átomo no sentido científico, pois o pensamento natural europeu era amplamente dominado pelo legado de Aristóteles, para quem a matéria é contínua, infinitamente divisível e estruturada pelos quatro elementos (terra, água, ar e fogo). Esta visão excluía a existência de unidades materiais indivisíveis e opunha-se explicitamente ao atomismo antigo. No entanto, no mundo islâmico medieval, algumas correntes da teologia racional, notadamente o kalām, desenvolveram uma forma de atomismo filosófico em que o mundo era composto por átomos discretos recriados a cada instante pela vontade divina. Este atomismo medieval não se baseava nem na experiência nem em leis matemáticas, mas numa intuição metafísica destinada a conciliar causalidade, contingência e onipotência divina. Assim, durante a Idade Média, o átomo subsistiu como conceito especulativo ou teológico, sem se tornar um objeto de descrição física ou de medição.
No início do século XIX d.C., John Dalton (1766-1844) introduziu uma teoria atômica baseada na química quantitativa. Os átomos tornaram-se entidades químicas e mensuráveis, caracterizadas pela sua massa, e responsáveis pelas leis de conservação. Cada elemento químico é constituído por átomos idênticos, distintos dos de outros elementos. Por exemplo, na formação da água, Dalton explicou que cada molécula resulta da combinação de dois átomos de hidrogênio e um átomo de oxigênio (H₂O), de acordo com proporções simples e constantes. Esta observação experimental ilustra como os átomos governam as reações químicas e suas proporções. Visualmente, pode-se imaginar que Dalton pensava no átomo como uma esfera compacta e homogênea, sem estrutura interna, apenas como "uma pequena bola de matéria".
O final do século XIX d.C. marcou uma ruptura decisiva na concepção do átomo. Em 1897, Joseph John Thomson (1856-1940) descobriu o elétron, demonstrando que o átomo não é indivisível. Ele propôs então um modelo em que os elétrons, portadores de carga negativa, estão dispersos em uma esfera de carga positiva difusa, como passas em um pudim. Este modelo permitia explicar certas propriedades elétricas dos átomos, mas não explicava a estabilidade do núcleo observada mais tarde.
Em 1911, Ernest Rutherford (1871-1937) interpretou o experimento de dispersão de partículas alfa. Ele demonstrou que a carga positiva e a maior parte da massa do átomo estão concentradas em um núcleo central compacto. Os elétrons gravitam em torno deste núcleo, e o átomo torna-se um sistema majoritariamente constituído de vazio. Este modelo corrigiu as limitações do modelo de Thomson e estabeleceu as bases para os desenvolvimentos quânticos posteriores.
O modelo planetário clássico é instável segundo o eletromagnetismo, pois, na física clássica, uma carga acelerada como um elétron em órbita irradia energia eletromagnética, perde progressivamente sua energia cinética e espirala inevitavelmente em direção ao núcleo. Para resolver esta contradição, Niels Bohr (1885-1962) introduziu em 1913 órbitas eletrônicas quantificadas. Os elétrons só podem ocupar certos níveis de energia, explicando os espectros atômicos discretos.
No início do século XX d.C., Louis de Broglie (1892-1987) propôs uma revolução conceitual: o elétron, e mais geralmente qualquer partícula material, possui ao mesmo tempo uma natureza de "partícula" e uma natureza de "onda". Esta ideia, chamada dualidade onda-partícula, sugere que o elétron em órbita ao redor do núcleo pode ser descrito como uma "onda estacionária", cujo comprimento de onda é inversamente proporcional à sua quantidade de movimento: \( \lambda = h / p \), onde \( \lambda \) é o comprimento de onda, \( h \) é a constante de Planck e \( p \) é a quantidade de movimento.
O modelo de de Broglie explica por que apenas certas órbitas são estáveis no átomo de Bohr: o elétron só pode ocupar as órbitas para as quais seu comprimento de onda forma um ciclo completo ao redor do núcleo, criando uma condição de ressonância. Este conceito constituiu uma etapa essencial para a "mecânica quântica", pois relacionou as propriedades corpusculares das partículas ao seu comportamento ondulatório, abrindo caminho para a equação de Schrödinger.
Na década de 1920 d.C., Werner Heisenberg (1901-1976) propôs uma nova abordagem do átomo baseada nos princípios da mecânica quântica. Seu modelo, chamado "mecânica quântica matricial", não procurava descrever a trajetória dos elétrons ao redor do núcleo, mas apenas as "grandezas observáveis", como as energias dos níveis atômicos e as probabilidades de transição entre eles. Heisenberg introduziu o famoso "princípio da incerteza", que estabelece que é impossível conhecer simultaneamente e com precisão a posição e a quantidade de movimento de um elétron (\( \Delta x \, \Delta p \ge \hbar / 2 \)).
Este modelo transformou radicalmente a compreensão do átomo: os elétrons já não eram vistos como partículas descritas por órbitas clássicas, mas como entidades cujo comportamento só podia ser expresso por grandezas mensuráveis. O modelo de Heisenberg é muito abstrato e não se presta a uma ilustração clássica de elétrons em órbita, ao contrário do de Bohr. Mas ainda assim pode ser representado de forma simbólica e pedagógica.
No início da década de 1920 d.C., a física clássica já não conseguia explicar a estabilidade dos átomos nem os espectros discretos observados experimentalmente. Erwin Schrödinger (1887-1961) desenvolveu então uma abordagem matemática baseada na mecânica ondulatória. Ele substituiu as trajetórias eletrônicas fixas por uma função de onda, cujo módulo ao quadrado indica a probabilidade de presença do elétron no espaço.
Esta abordagem descreve os elétrons como "nuvens de probabilidade" organizadas em orbitais atômicos, caracterizados por números quânticos que definem energia, forma e orientação. O modelo de Schrödinger explica a estabilidade dos átomos, os espectros atômicos e serve como fundamento para toda a química quântica moderna.
N.B.:
Ao contrário dos modelos clássicos, o elétron não tem uma trajetória definida. A mecânica quântica só descreve probabilidades de presença e energia.
| Modelo | Cientista | Período | Característica principal |
|---|---|---|---|
| Átomo indivisível | Demócrito (c. 460-370 a.C.) | Século V a.C. | Partícula sem estrutura interna |
| Átomo químico | John Dalton (1766-1844) | Século XIX d.C. | Massa definida, base das reações químicas |
| Modelo de Thomson | Joseph John Thomson (1856-1940) | Final do século XIX d.C. | Elétrons mergulhados em uma carga positiva difusa |
| Modelo nuclear | Ernest Rutherford (1871-1937) | Início do século XX d.C. | Núcleo central e elétrons periféricos |
| Modelo quantificado | Niels Bohr (1885-1962) | Início do século XX d.C. | Níveis de energia discretos |
| Modelo ondulatório | Louis de Broglie (1892-1987) | Século XX d.C. | Dualidade onda-partícula aplicada ao elétron |
| Modelo matricial | Werner Heisenberg (1901-1976) | Século XX d.C. | Grandezas observáveis, princípio da incerteza, trajetórias indeterminadas |
| Modelo quântico | Erwin Schrödinger (1887-1961) | Século XX d.C. | Função de onda e orbitais de probabilidade |