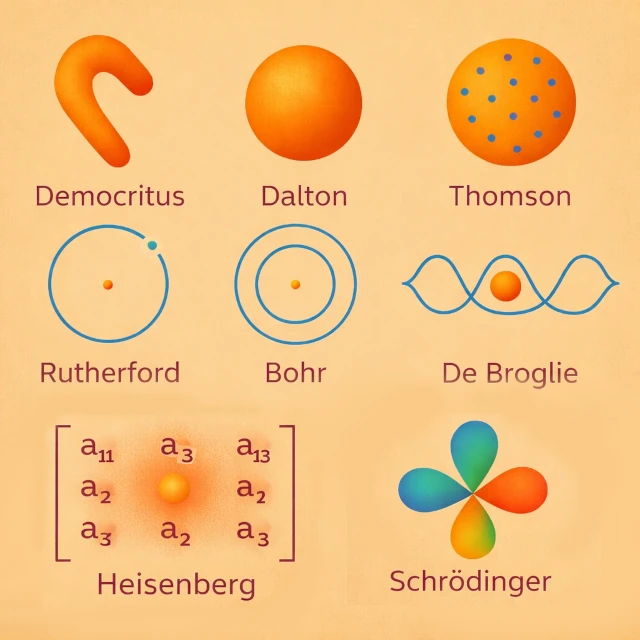
原子の概念は紀元前5世紀にデモクリトス(紀元前460年-紀元前370年頃)によって登場しました。彼は、本質的に直感的かつ合理的なアプローチによって、真空中を移動する不可分な粒子の存在を仮定しました。 この提案は実験的観測に基づくものではなく、物質の無限の分割可能性という問題を解決するための哲学的直感に基づいていました。 当時、この仮説を検証する実験はありませんでした。 原子は、内部構造や測定可能な性質を持たない物質の究極の単位として考えられていました。 デモクリトにとって、原子は独自の形を持ち、物体の性質を直感的に説明するものでした。例えば、かぎ状の原子は互いに絡み合い、ざらざらした質感を生み出し、丸い原子や滑らかな原子は流動的または柔らかい物質を生み出しました。
中世には、科学的な意味での原子の物理的モデル化は存在しませんでした。なぜなら、ヨーロッパの自然思想は、アリストテレスの遺産によって大きく支配されており、彼にとって物質は連続的で、無限に分割可能であり、四元素(土、水、空気、火)によって構造化されていました。 この見方は、不可分な物質単位の存在を排除し、古代の原子論に明確に反対していました。 しかし、中世イスラム世界では、合理的神学の一部の流れ、特にカラームは、世界が神の意志によって瞬間ごとに再創造される離散的な原子から構成されているという形の哲学的原子論を発展させました。 この中世の原子論は、経験や数学的法則に基づくものではなく、因果性、偶然性、神の全能を調和させることを目的とした形而上的な直感に基づいていました。 このように、中世において原子は、物理的記述や測定の対象となることなく、思弁的または神学的な概念として存続しました。
19世紀初頭、ジョン・ドルトン(1766-1844)は、定量化学に基づく原子論を導入しました。 原子は、質量によって特徴づけられる化学的かつ測定可能な実体となり、保存則の責任を負うようになりました。 各化学元素は、他の元素の原子とは異なる同一の原子から構成されています。 例えば、水の形成において、ドルトンは各分子が2つの水素原子と1つの酸素原子(H₂O)の組み合わせによって生じ、単純で一定の割合に従っていると説明しました。 この実験的観察は、原子が化学反応とその割合をどのように支配しているかを示しています。 視覚的には、ドルトンが原子を内部構造のないコンパクトで均質な球、つまり「小さな物質の玉」として考えていたと想像できます。
19世紀末は、原子の概念における決定的な転換点となりました。 1897年、ジョセフ・ジョン・トムソン(1856-1940)は電子を発見し、原子が不可分ではないことを証明しました。 彼は、電子が負の電荷を持ち、プディングの中のレーズンのように、拡散した正の電荷の球体の中に分散しているというモデルを提案しました。 このモデルは、原子の一部の電気的性質を説明することができましたが、後に観察された原子核の安定性については説明できませんでした。
1911年、アーネスト・ラザフォード(1871-1937)はアルファ粒子散乱実験を解釈しました。 彼は、原子の正電荷と質量のほとんどがコンパクトな中心核に集中していることを証明しました。 電子はこの核の周りを回り、原子は主に空虚な空間から成るシステムとなりました。 このモデルはトムソンのモデルの限界を修正し、後の量子的発展の基礎を築きました。
古典的な惑星モデルは電磁気学的に不安定です。古典物理学では、電子のような加速された電荷は電磁エネルギーを放射し、徐々に運動エネルギーを失い、最終的に核に向かってらせん状に落ちていきます。 この矛盾を解決するため、ニールス・ボーア(1885-1962)は1913年に量子化された電子軌道を導入しました。 電子は特定のエネルギーレベルしか占めることができず、これが離散的な原子スペクトルを説明します。
20世紀初頭、ルイ・ド・ブロイ(1892-1987)は概念的な革命を提案しました:電子、そして一般的にすべての物質粒子は、「粒子」と「波」の両方の性質を持っています。 この考えは波動-粒子二重性と呼ばれ、核の周りを回る電子は「定常波」として記述でき、その波長は運動量に反比例することを示唆しています:\( \lambda = h / p \)、ここで\( \lambda \)は波長、\( h \)はプランク定数、\( p \)は運動量です。
ド・ブロイのモデルは、ボーアの原子でなぜ特定の軌道だけが安定しているのかを説明します:電子は、その波長が核の周りで完全なサイクルを形成し、共鳴条件を作り出す軌道にしか存在できません。 この概念は、「量子力学」への重要なステップであり、粒子の粒子的性質をその波動的挙動と結びつけ、シュレーディンガー方程式への道を開きました。
20世紀初頭、ヴェルナー・ハイゼンベルク(1901-1976)は量子力学の原理に基づく新しい原子アプローチを提案しました。 彼の「行列力学」モデルは、電子の核周りの軌道を記述しようとはせず、「観測可能な量」、つまり原子レベルのエネルギーやそれらの間の遷移確率のみを記述しようとしました。 ハイゼンベルクは、電子の位置と運動量を同時に精密に知ることは不可能であるという有名な「不確定性原理」を導入しました(\( \Delta x \, \Delta p \ge \hbar / 2 \))。
このモデルは原子の理解を根本的に変えました:電子はもはや古典的な軌道で記述される粒子として見なされず、その振る舞いは測定可能な量によってのみ表現できる実体として見なされるようになりました。 ハイゼンベルクのモデルは非常に抽象的で、ボーアのモデルとは異なり、軌道上の電子の古典的なイラストには適しません。 しかし、象徴的かつ教育的に表現することは可能です。
20世紀初頭、古典物理学は原子の安定性や実験的に観察された離散的なスペクトルを説明できなくなりました。 エルヴィン・シュレーディンガー(1887-1961)は、波動力学に基づく数学的アプローチを開発しました。 彼は固定された電子軌道を、電子の存在確率を表す波動関数に置き換えました。その絶対値の二乗は、空間における電子の存在確率を示します。
このアプローチは、電子を原子軌道に組織化された「確率雲」として記述します。原子軌道は、エネルギー、形状、方向を定義する量子数によって特徴づけられます。 シュレーディンガーのモデルは、原子の安定性、原子スペクトルを説明し、現代の量子化学の基礎を提供します。
N.B.:
古典的なモデルとは異なり、電子は定義された軌道を持ちません。量子力学は存在とエネルギーの確率のみを記述します。
| モデル | 科学者 | 時代 | 主な特徴 |
|---|---|---|---|
| 不可分な原子 | デモクリトス(紀元前460年-紀元前370年頃) | 紀元前5世紀 | 内部構造のない粒子 |
| 化学的原子 | ジョン・ドルトン(1766-1844) | 19世紀 | 定義された質量、化学反応の基礎 |
| トムソンのモデル | ジョセフ・ジョン・トムソン(1856-1940) | 19世紀末 | 拡散した正電荷の中の電子 |
| 原子核モデル | アーネスト・ラザフォード(1871-1937) | 20世紀初頭 | 中心核と周辺電子 |
| 量子化モデル | ニールス・ボーア(1885-1962) | 20世紀初頭 | 離散的なエネルギーレベル |
| 波動モデル | ルイ・ド・ブロイ(1892-1987) | 20世紀 | 電子に適用された波動-粒子二重性 |
| 行列モデル | ヴェルナー・ハイゼンベルク(1901-1976) | 20世紀 | 観測可能な量、不確定性原理、不確定な軌道 |
| 量子モデル | エルヴィン・シュレーディンガー(1887-1961) | 20世紀 | 波動関数と確率軌道 |