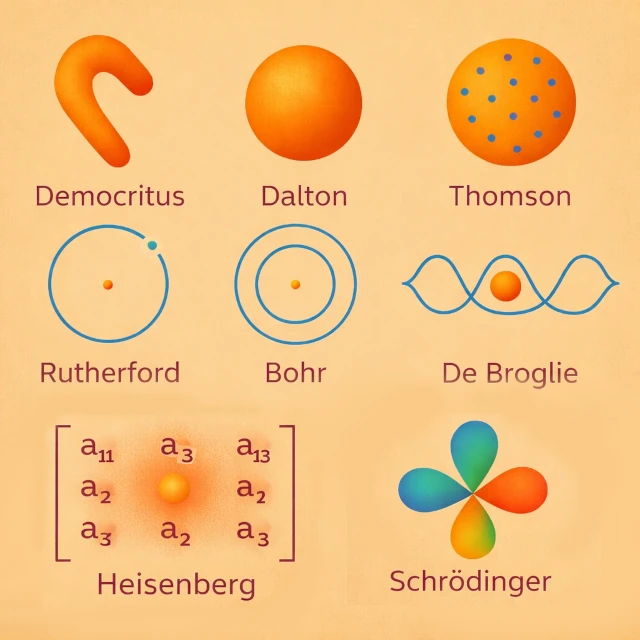
Das Konzept des Atoms erschien im 5. Jahrhundert v. Chr. mit Demokrit (ca. 460-370 v. Chr.), der durch einen im Wesentlichen intuitiven und rationalen Ansatz die Existenz unteilbarer Teilchen postulierte, die sich im leeren Raum bewegen. Dieser Vorschlag basierte nicht auf experimenteller Beobachtung, sondern auf einer philosophischen Intuition, die das Problem der unendlichen Teilbarkeit der Materie lösen sollte. Kein Experiment konnte diese Hypothese damals testen. Das Atom wurde somit als die letzte Einheit der Materie gedacht, ohne innere Struktur oder messbare Eigenschaften. Für Demokrit besaß das Atom eine eigene Form, die intuitiv die Eigenschaften der Körper erklärte: Zum Beispiel verhakten sich hakenförmige Atome und ergaben raue Texturen, während runde oder glatte Atome flüssige oder weiche Substanzen bildeten.
Im Mittelalter gab es keine physikalische Modellierung des Atoms im wissenschaftlichen Sinne, da das europäische Naturdenken weitgehend vom Erbe Aristoteles' geprägt war, für den die Materie kontinuierlich, unendlich teilbar und durch die vier Elemente (Erde, Wasser, Luft und Feuer) strukturiert war. Diese Sichtweise schloss die Existenz unteilbarer materieller Einheiten aus und widersprach explizit dem antiken Atomismus. Allerdings entwickelten im mittelalterlichen islamischen Raum einige Strömungen der rationalen Theologie, insbesondere der Kalām, eine Form des philosophischen Atomismus, in der die Welt aus diskreten Atomen bestand, die in jedem Augenblick durch den göttlichen Willen neu geschaffen wurden. Dieser mittelalterliche Atomismus beruhte weder auf Erfahrung noch auf mathematischen Gesetzen, sondern auf einer metaphysischen Intuition, die Kausalität, Kontingenz und göttliche Allmacht in Einklang bringen sollte. So blieb das Atom im Mittelalter ein spekulatives oder theologisches Konzept, ohne zu einem Gegenstand physikalischer Beschreibung oder Messung zu werden.
Zu Beginn des 19. Jahrhunderts n. Chr. führte John Dalton (1766-1844) eine Atomtheorie ein, die auf der quantitativen Chemie basierte. Atome wurden zu chemischen und messbaren Entitäten, die durch ihre Masse gekennzeichnet sind, und waren für die Erhaltungssätze verantwortlich. Jedes chemische Element besteht aus identischen Atomen, die sich von denen anderer Elemente unterscheiden. Zum Beispiel erklärte Dalton bei der Bildung von Wasser, dass jedes Molekül aus der Kombination von zwei Wasserstoffatomen und einem Sauerstoffatom (H₂O) entsteht, entsprechend einfachen und konstanten Proportionen. Diese experimentelle Beobachtung zeigt, wie Atome chemische Reaktionen und ihre Proportionen steuern. Visuell kann man sich vorstellen, dass Dalton das Atom als eine kompakte und homogene Kugel ohne innere Struktur dachte, einfach als "ein kleines Materiekügelchen".
Das Ende des 19. Jahrhunderts n. Chr. markierte einen entscheidenden Bruch in der Vorstellung des Atoms. 1897 entdeckte Joseph John Thomson (1856-1940) das Elektron und zeigte damit, dass das Atom nicht unteilbar ist. Er schlug ein Modell vor, in dem die Elektronen, die negative Ladung tragen, in einer diffusen Kugel positiver Ladung verteilt sind, wie Rosinen in einem Kuchen. Dieses Modell konnte bestimmte elektrische Eigenschaften der Atome erklären, aber nicht die Stabilität des Kerns, die später beobachtet wurde.
1911 interpretierte Ernest Rutherford (1871-1937) das Alpha-Teilchen-Streuexperiment. Er zeigte, dass die positive Ladung und der Großteil der Masse des Atoms in einem kompakten zentralen Kern konzentriert sind. Die Elektronen umkreisen diesen Kern, und das Atom wird zu einem System, das hauptsächlich aus leerem Raum besteht. Dieses Modell korrigierte die Grenzen des Thomson-Modells und legte den Grundstein für die späteren quantenmechanischen Entwicklungen.
Das klassische Planetensystemmodell ist nach dem Elektromagnetismus instabil, da in der klassischen Physik eine beschleunigte Ladung wie ein Elektron in der Umlaufbahn elektromagnetische Energie abstrahlt, allmählich seine kinetische Energie verliert und unweigerlich in den Kern spiralt. Um diesen Widerspruch zu lösen, führte Niels Bohr (1885-1962) 1913 quantisierte Elektronenbahnen ein. Elektronen können nur bestimmte Energieniveaus besetzen, was die diskreten Atomspektren erklärt.
Zu Beginn des 20. Jahrhunderts n. Chr. schlug Louis de Broglie (1892-1987) eine konzeptionelle Revolution vor: Das Elektron und allgemein jedes materielle Teilchen besitzt sowohl eine "Teilchen"- als auch eine "Wellen"-Natur. Diese Idee, Welle-Teilchen-Dualismus genannt, legt nahe, dass das Elektron, das den Kern umkreist, als "stehende Welle" beschrieben werden kann, deren Wellenlänge umgekehrt proportional zu seinem Impuls ist: \( \lambda = h / p \), wobei \( \lambda \) die Wellenlänge, \( h \) das Plancksche Wirkungsquantum und \( p \) der Impuls ist.
Das de-Broglie-Modell erklärt, warum nur bestimmte Bahnen im Bohrschen Atom stabil sind: Das Elektron kann nur die Bahnen besetzen, für die seine Wellenlänge einen vollständigen Zyklus um den Kern bildet und eine Resonanzbedingung schafft. Dieses Konzept war ein wesentlicher Schritt zur "Quantenmechanik", da es die korpuskularen Eigenschaften der Teilchen mit ihrem Wellenverhalten verband und den Weg für die Schrödinger-Gleichung ebnete.
In den 1920er Jahren n. Chr. schlug Werner Heisenberg (1901-1976) einen neuen Ansatz für das Atom vor, der auf den Prinzipien der Quantenmechanik basierte. Sein Modell, die "Matrizenmechanik", versuchte nicht, die Bahn der Elektronen um den Kern zu beschreiben, sondern nur die "beobachtbaren Größen" wie die Energien der atomaren Niveaus und die Übergangswahrscheinlichkeiten zwischen ihnen. Heisenberg führte das berühmte "Unschärfeprinzip" ein, das besagt, dass es unmöglich ist, gleichzeitig und genau sowohl den Ort als auch den Impuls eines Elektrons zu kennen (\( \Delta x \, \Delta p \ge \hbar / 2 \)).
Dieses Modell veränderte das Verständnis des Atoms radikal: Elektronen wurden nicht mehr als Teilchen gesehen, die durch klassische Bahnen beschrieben werden, sondern als Entitäten, deren Verhalten nur durch messbare Größen ausgedrückt werden kann. Heisenbergs Modell ist sehr abstrakt und eignet sich nicht für eine klassische Illustration von Elektronen in Umlaufbahnen, im Gegensatz zu Bohrs Modell. Aber es kann trotzdem symbolisch und pädagogisch dargestellt werden.
Zu Beginn der 1920er Jahre n. Chr. konnte die klassische Physik die Stabilität der Atome und die experimentell beobachteten diskreten Spektren nicht mehr erklären. Erwin Schrödinger (1887-1961) entwickelte daraufhin einen mathematischen Ansatz, der auf der Wellenmechanik basierte. Er ersetzte die festen Elektronenbahnen durch eine Wellfunktion, deren Betragsquadrat die Aufenthaltswahrscheinlichkeit des Elektrons im Raum angibt.
Dieser Ansatz beschreibt Elektronen als "Wahrscheinlichkeitswolken", die in Atomorbitalen organisiert sind, die durch Quantenzahlen gekennzeichnet sind, die Energie, Form und Orientierung definieren. Das Schrödinger-Modell erklärt die Stabilität der Atome, die Atomspektren und dient als Grundlage für die gesamte moderne Quantenchemie.
N.B.:
Im Gegensatz zu klassischen Modellen hat das Elektron keine definierte Bahn. Die Quantenmechanik beschreibt nur Aufenthalts- und Energie-Wahrscheinlichkeiten.
| Modell | Wissenschaftler | Zeitraum | Hauptmerkmal |
|---|---|---|---|
| Unteilbares Atom | Demokrit (ca. 460-370 v. Chr.) | 5. Jahrhundert v. Chr. | Teilchen ohne innere Struktur |
| Chemisches Atom | John Dalton (1766-1844) | 19. Jahrhundert n. Chr. | Definierte Masse, Grundlage chemischer Reaktionen |
| Thomson-Modell | Joseph John Thomson (1856-1940) | Ende 19. Jahrhundert n. Chr. | Elektronen in einer diffusen positiven Ladung |
| Kernmodell | Ernest Rutherford (1871-1937) | Anfang 20. Jahrhundert n. Chr. | Zentraler Kern und periphere Elektronen |
| Quantisiertes Modell | Niels Bohr (1885-1962) | Anfang 20. Jahrhundert n. Chr. | Diskrete Energieniveaus |
| Wellenmodell | Louis de Broglie (1892-1987) | 20. Jahrhundert n. Chr. | Welle-Teilchen-Dualismus auf das Elektron angewandt |
| Matrizenmodell | Werner Heisenberg (1901-1976) | 20. Jahrhundert n. Chr. | Beobachtbare Größen, Unschärfeprinzip, unbestimmte Bahnen |
| Quantenmodell | Erwin Schrödinger (1887-1961) | 20. Jahrhundert n. Chr. | Wellenfunktion und Wahrscheinlichkeitsorbitale |