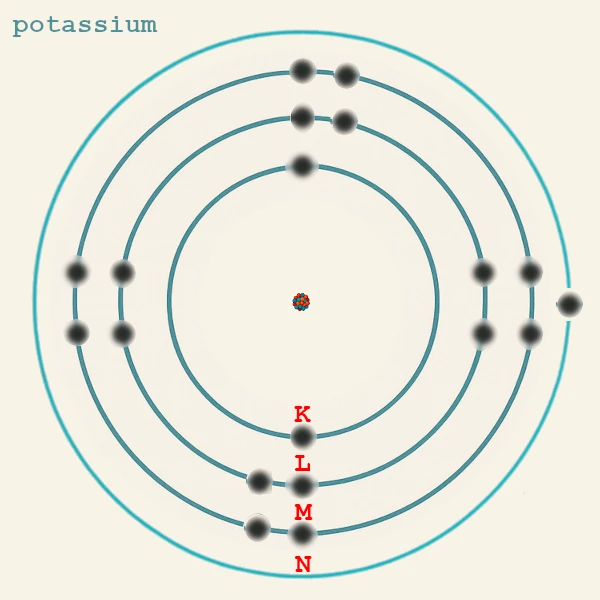
Um die Verteilung der Elektronen um den Atomkern zu beschreiben, verwenden Physiker eine einfache historische Notation: die Elektronenschalen K, L, M, N, O, P und Q. Diese Notation wurde Anfang des 20. Jahrhunderts vom Physiker Charles Barkla (1877-1944) während der Untersuchung von Röntgenstrahlen eingeführt. Diese Notation ermöglicht eine schnelle Visualisierung, wie sich die Elektronen auf steigende Energieniveaus verteilen, von der Schale, die dem Kern am nächsten ist (K), bis zu den äußeren Schalen.
Jeder Buchstabe entspricht einer Hauptquantenzahl n:
K-Schale: n = 1 (erste Schale, dem Kern am nächsten)
L-Schale: n = 2 (zweite Schale)
M-Schale: n = 3 (dritte Schale)
N-Schale: n = 4 (vierte Schale)
O-Schale: n = 5 (fünfte Schale)
P-Schale: n = 6 (sechste Schale)
Q-Schale: n = 7 (siebte Schale)
Jede Schale kann eine maximale Anzahl von Elektronen aufnehmen, die durch die Formel 2n² definiert ist:
K-Schale (n=1): maximal 2 Elektronen (2 × 1² = 2)
L-Schale (n=2): maximal 8 Elektronen (2 × 2² = 8)
M-Schale (n=3): maximal 18 Elektronen (2 × 3² = 18)
N-Schale (n=4): maximal 32 Elektronen (2 × 4² = 32) → Uran erreicht dies: K(2) L(8) M(18) N(32)
O-Schale (n=5): maximal 50 Elektronen (2 × 5² = 50) → Nie erreicht (Uran hat nur 21 Elektronen in O)
P-Schale (n=6): maximal 72 Elektronen (2 × 6² = 72) → Nie erreicht
Q-Schale (n=7): maximal 98 Elektronen (2 × 7² = 98) → Nie erreicht
N.B.:
In der Praxis füllt kein bekanntes Element die Schalen über N hinaus vollständig. Das schwerste natürliche Element, Uran (Z=92), hat die Konfiguration K(2) L(8) M(18) N(32) O(21) P(9) Q(2). Das schwerste bestätigte synthetische Element, Oganesson (Z=118), hat die Konfiguration K(2) L(8) M(18) N(32) O(32) P(18) Q(8).
Jede Schale ist in Unterschalen unterteilt, die durch die Buchstaben s, p, d, f bezeichnet werden:
s-Unterschale: kann bis zu 2 Elektronen enthalten (1 Orbital)
p-Unterschale: kann bis zu 6 Elektronen enthalten (3 Orbitale)
d-Unterschale: kann bis zu 10 Elektronen enthalten (5 Orbitale)
f-Unterschale: kann bis zu 14 Elektronen enthalten (7 Orbitale)
K-Schale (n=1): enthält nur 1s (2 Elektronen max.)
L-Schale (n=2): enthält 2s und 2p (2 + 6 = 8 Elektronen max.)
M-Schale (n=3): enthält 3s, 3p und 3d (2 + 6 + 10 = 18 Elektronen max.)
N-Schale (n=4): enthält 4s, 4p, 4d und 4f (2 + 6 + 10 + 14 = 32 Elektronen max.)
O-Schale (n=5): enthält 5s, 5p, 5d und 5f (2 + 6 + 10 + 14 = 32 Elektronen max. theoretisch, obwohl die theoretische 5g-Unterschale in bekannten Elementen nicht existiert)
P-Schale (n=6): enthält 6s, 6p, 6d und 6f (2 + 6 + 10 + 14 = 32 Elektronen max. für bekannte Unterschalen)
Q-Schale (n=7): enthält 7s, 7p und potenziell 7d (nur 7s- und 7p-Elektronen werden in bekannten Elementen beobachtet)
Diese Notation gibt die Gesamtzahl der Elektronen in jeder Schale an, ohne die Unterschalen zu detaillieren. Sie ist besonders nützlich, um die gesamte Elektronenverteilung eines Atoms schnell zu visualisieren.
Helium (2 Elektronen): 1s² → K(2)
Die K-Schale ist vollständig und gesättigt.
Neon (10 Elektronen): 1s² 2s² 2p⁶ → K(2) L(8)
Die K- und L-Schalen sind vollständig und gesättigt.
Natrium (11 Elektronen): 1s² 2s² 2p⁶ 3s¹ → K(2) L(8) M(1)
Die K- und L-Schalen sind vollständig, die M-Schale enthält nur 1 Elektron von 18 möglichen.
Argon (18 Elektronen): 1s² 2s² 2p⁶ 3s² 3p⁶ → K(2) L(8) M(8)
Die K- und L-Schalen sind vollständig. Die M-Schale enthält 8 Elektronen, ist aber nicht vollständig (die 3s- und 3p-Unterschalen sind gesättigt, aber 3d bleibt leer).
Calcium (20 Elektronen): 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² → K(2) L(8) M(8) N(2)
Beachten Sie, dass die 4s-Unterschale vor der 3d gefüllt wird, was erklärt, warum die M-Schale bei 8 Elektronen bleibt.
Titan (22 Elektronen): 1s² 2s² 2p⁶ 3s² 3p⁶ 3d² 4s² → K(2) L(8) M(10) N(2)
Die M-Schale beginnt sich mit den 3d-Elektronen zu füllen.
Die Füllreihenfolge folgt nicht streng der Reihenfolge der K-, L-, M-, N-Schalen… aufgrund der Energieniveaus der Unterschalen. Die allgemeine Reihenfolge ist:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d…
Dieses Prinzip erklärt, warum zum Beispiel Kalium (19 Elektronen) die Konfiguration K(2) L(8) M(8) N(1) hat: das 19. Elektron geht in 4s statt in 3d, weil die 4s-Unterschale eine niedrigere Energie als 3d hat.
Die K-, L-, M-, N-, O-, P-, Q-Notation ermöglicht:
• Schnelle Visualisierung der gesamten Elektronenstruktur eines Atoms
• Einfache Identifizierung der Valenzschale (äußere Schale)
• Verständnis der chemischen Eigenschaften im Zusammenhang mit Valenzelektronen
• Erklärung der Klassifizierung der Elemente im Periodensystem
• Vorhersage der Oxidationsstufen und der chemischen Reaktivität der Elemente
Die chemische Reaktivität der Elemente hat ihren Ursprung in ihrer Elektronenstruktur, insbesondere in der Konfiguration ihrer Valenzschale. Die äußere Schale, oder Valenzschale, bestimmt die Fähigkeit eines Elements, chemische Bindungen zu bilden: Atome neigen dazu, Elektronen zu gewinnen, zu verlieren oder zu teilen, um eine stabile Konfiguration zu erreichen, in der Regel die des nächstgelegenen Edelgases.
Diese Tendenz erklärt die beobachteten chemischen Affinitäten: Alkalimetalle, mit einem einzigen Valenzelektron, geben es leicht ab, um Kationen zu bilden; Halogene, denen ein Elektron zur Vervollständigung ihrer äußeren Schale fehlt, sind elektronenhungrig und bilden Anionen; während Edelgase, mit einer vollständigen Valenzschale, chemisch inert bleiben. Zwischen diesen Extremen zeigen Übergangsmetalle und Halbmetalle intermediäres Verhalten und können je nach Bedingungen verschiedene Arten von Bindungen bilden.
Das Verständnis dieser Struktur-Eigenschafts-Beziehungen bildet die Grundlage der modernen Chemie und ermöglicht die Vorhersage des Verhaltens von Elementen in chemischen Reaktionen.
| Element | Symbol (Z) | Valenzschale | Valenzelektronen | Valenzkonfiguration | Affinität zu anderen Elementen (Beispiele) |
|---|---|---|---|---|---|
| Wasserstoff | H (Z = 1) | n = 1 | 1 | 1s¹ | Kovalente Bindungen mit O (H₂O), C (CH₄), N (NH₃). |
| Helium | He (Z = 2) | n = 1 | 2 | 1s² | Fast keine chemische Affinität; inertes Edelgas. |
| Lithium | Li (Z = 3) | n = 2 | 1 | 2s¹ | Ionenbindungen mit F (LiF), O (Li₂O). |
| Beryllium | Be (Z = 4) | n = 2 | 2 | 2s² | Kovalente Bindungen mit O (BeO), C (Be₂C). |
| Bor | B (Z = 5) | n = 2 | 3 | 2s² 2p¹ | Defizitäre Bindungen mit F (BF₃), H (Borane). |
| Kohlenstoff | C (Z = 6) | n = 2 | 4 | 2s² 2p² | Kovalente Bindungen mit H, O (CO₂), N. |
| Stickstoff | N (Z = 7) | n = 2 | 5 | 2s² 2p³ | Mehrfachbindungen mit H (NH₃), C (CN⁻). |
| Sauerstoff | O (Z = 8) | n = 2 | 6 | 2s² 2p⁴ | Hauptoxidationsmittel; Bindungen mit H, C, Metallen. |
| Fluor | F (Z = 9) | n = 2 | 7 | 2s² 2p⁵ | Sehr hohe Elektronegativität; Ionenbindungen. |
| Neon | Ne (Z = 10) | n = 2 | 8 | 2s² 2p⁶ | Inertes Edelgas. |
| Natrium | Na (Z = 11) | n = 3 | 1 | 3s¹ | Ionenbindungen mit Cl (NaCl), O. |
| Magnesium | Mg (Z = 12) | n = 3 | 2 | 3s² | Ionenbindungen mit O (MgO). |
| Aluminium | Al (Z = 13) | n = 3 | 3 | 3s² 3p¹ | Metallische und kovalente Bindungen (Al₂O₃). |
| Silicium | Si (Z = 14) | n = 3 | 4 | 3s² 3p² | Kovalente Netzwerke (SiO₂). |
| Phosphor | P (Z = 15) | n = 3 | 5 | 3s² 3p³ | Bindungen mit O (PO₄³⁻), H. |
| Schwefel | S (Z = 16) | n = 3 | 6 | 3s² 3p⁴ | Bindungen mit H (H₂S), O (SO₂). |
| Chlor | Cl (Z = 17) | n = 3 | 7 | 3s² 3p⁵ | Ionenbindungen mit Na, kovalente mit H. |
| Argon | Ar (Z = 18) | n = 3 | 8 | 3s² 3p⁶ | Inertes Edelgas. |
| Kalium | K (Z = 19) | n = 4 | 1 | 4s¹ | Ionenbindungen mit Cl (KCl), O. |
| Calcium | Ca (Z = 20) | n = 4 | 2 | 4s² | Ionenbindungen mit O (CaO), Carbonate. |
| Scandium | Sc (Z = 21) | n = 4 | 3 | 4s² 3d¹ | Metallische Bindungen; Oxide Sc₂O₃. |
| Titan | Ti (Z = 22) | n = 4 | 4 | 4s² 3d² | Metallische Bindungen; Oxide TiO₂. |
| Vanadium | V (Z = 23) | n = 4 | 5 | 4s² 3d³ | Mehrere Oxidationsstufen; V₂O₅. |
| Chrom | Cr (Z = 24) | n = 4 | 6 | 4s¹ 3d⁵ | Metallische Bindungen; Oxide Cr₂O₃. |
| Mangan | Mn (Z = 25) | n = 4 | 7 | 4s² 3d⁵ | Verschiedene Oxidationsstufen; MnO₂. |
| Eisen | Fe (Z = 26) | n = 4 | 2–3 | 4s² 3d⁶ | Metallische Bindungen; Oxide Fe₂O₃. |
| Kobalt | Co (Z = 27) | n = 4 | 2–3 | 4s² 3d⁷ | Metallische Bindungen; Komplexe CoO. |
| Nickel | Ni (Z = 28) | n = 4 | 2 | 4s² 3d⁸ | Metallische Bindungen; Katalysator NiO. |
| Kupfer | Cu (Z = 29) | n = 4 | 1–2 | 4s¹ 3d¹⁰ | Metallische Bindungen; Oxide CuO. |
| Zink | Zn (Z = 30) | n = 4 | 2 | 4s² 3d¹⁰ | Ionenbindungen mit O, S. |
| Gallium | Ga (Z = 31) | n = 4 | 3 | 4s² 4p¹ | Metallische Bindungen; Halbleiter GaAs. |
| Germanium | Ge (Z = 32) | n = 4 | 4 | 4s² 4p² | Halbleiter; kovalente Bindungen GeO₂. |
| Arsen | As (Z = 33) | n = 4 | 5 | 4s² 4p³ | Kovalente Bindungen mit S, O. |
| Selen | Se (Z = 34) | n = 4 | 6 | 4s² 4p⁴ | Analog zu Schwefel; H₂Se. |
| Brom | Br (Z = 35) | n = 4 | 7 | 4s² 4p⁵ | Halogen; Bindungen mit H, Metallen. |
| Krypton | Kr (Z = 36) | n = 4 | 8 | 4s² 4p⁶ | Fast inertes Edelgas. |
| Rubidium | Rb (Z = 37) | n = 5 | 1 | 5s¹ | Alkalimetall; Ionenbindungen RbCl. |
| Strontium | Sr (Z = 38) | n = 5 | 2 | 5s² | Ionenbindungen mit O (SrO). |
| Yttrium | Y (Z = 39) | n = 5 | 3 | 5s² 4d¹ | Übergangsmetall; Y₂O₃. |
| Zirconium | Zr (Z = 40) | n = 5 | 4 | 5s² 4d² | Metallische Bindungen; ZrO₂. |
| Niob | Nb (Z = 41) | n = 5 | 5 | 5s¹ 4d⁴ | Supraleiter; Nb₂O₅. |
| Molybdän | Mo (Z = 42) | n = 5 | 6 | 5s¹ 4d⁵ | Metallische Bindungen; MoS₂. |
| Technetium | Tc (Z = 43) | n = 5 | 7 | 5s² 4d⁵ | Radioaktiv; Komplexe mit O. |
| Ruthenium | Ru (Z = 44) | n = 5 | 8 | 5s¹ 4d⁷ | Katalysator; RuO₂. |
| Rhodium | Rh (Z = 45) | n = 5 | 9 | 5s¹ 4d⁸ | Katalysator; Rh₂O₃. |
| Palladium | Pd (Z = 46) | n = 5 | 10 | 4d¹⁰ | Katalysator; PdO. |
| Silber | Ag (Z = 47) | n = 5 | 1 | 5s¹ 4d¹⁰ | Metallische Bindungen; Ag₂O. |
| Cadmium | Cd (Z = 48) | n = 5 | 2 | 5s² 4d¹⁰ | Ionenbindungen; CdS. |
| Indium | In (Z = 49) | n = 5 | 3 | 5s² 5p¹ | Halbleiter; In₂O₃. |
| Zinn | Sn (Z = 50) | n = 5 | 4 | 5s² 5p² | Metallische Bindungen; SnO₂. |
| Antimon | Sb (Z = 51) | n = 5 | 5 | 5s² 5p³ | Halbmetall; Sb₂O₃. |
| Tellur | Te (Z = 52) | n = 5 | 6 | 5s² 5p⁴ | Halbmetall; H₂Te. |
| Iod | I (Z = 53) | n = 5 | 7 | 5s² 5p⁵ | Halogen; Bindungen mit H, Metallen. |
| Xenon | Xe (Z = 54) | n = 5 | 8 | 5s² 5p⁶ | Edelgas; Verbindungen mit F (XeF₄). |
| Cäsium | Cs (Z = 55) | n = 6 | 1 | 6s¹ | Sehr reaktives Alkalimetall; CsCl. |
| Barium | Ba (Z = 56) | n = 6 | 2 | 6s² | Ionenbindungen; BaO. |
| Lanthan | La (Z = 57) | n = 6 | 3 | 6s² 5d¹ | Lanthanid; La₂O₃. |
| Cer | Ce (Z = 58) | n = 6 | 3–4 | 6s² 4f¹ 5d¹ | Lanthanid; CeO₂. |
| Praseodym | Pr (Z = 59) | n = 6 | 3 | 6s² 4f³ | Lanthanid; Pr₂O₃. |
| Neodym | Nd (Z = 60) | n = 6 | 3 | 6s² 4f⁴ | Starke Magnete; Nd₂O₃. |
| Promethium | Pm (Z = 61) | n = 6 | 3 | 6s² 4f⁵ | Radioaktiv; Pm₂O₃. |
| Samarium | Sm (Z = 62) | n = 6 | 2–3 | 6s² 4f⁶ | Magnete; Sm₂O₃. |
| Europium | Eu (Z = 63) | n = 6 | 2–3 | 6s² 4f⁷ | Leuchtstoff; Eu₂O₃. |
| Gadolinium | Gd (Z = 64) | n = 6 | 3 | 6s² 4f⁷ 5d¹ | Magnetisch; Gd₂O₃. |
| Terbium | Tb (Z = 65) | n = 6 | 3 | 6s² 4f⁹ | Leuchtstoff; Tb₂O₃. |
| Dysprosium | Dy (Z = 66) | n = 6 | 3 | 6s² 4f¹⁰ | Magnete; Dy₂O₃. |
| Holmium | Ho (Z = 67) | n = 6 | 3 | 6s² 4f¹¹ | Magnetisch; Ho₂O₃. |
| Erbium | Er (Z = 68) | n = 6 | 3 | 6s² 4f¹² | Optisch; Er₂O₃. |
| Thulium | Tm (Z = 69) | n = 6 | 3 | 6s² 4f¹³ | Laser; Tm₂O₃. |
| Ytterbium | Yb (Z = 70) | n = 6 | 2–3 | 6s² 4f¹⁴ | Yb₂O₃. |
| Lutetium | Lu (Z = 71) | n = 6 | 3 | 6s² 4f¹⁴ 5d¹ | Lu₂O₃. |
| Hafnium | Hf (Z = 72) | n = 6 | 4 | 6s² 4f¹⁴ 5d² | Metallische Bindungen; HfO₂. |
| Tantal | Ta (Z = 73) | n = 6 | 5 | 6s² 4f¹⁴ 5d³ | Resistent; Ta₂O₅. |
| Wolfram | W (Z = 74) | n = 6 | 6 | 6s² 4f¹⁴ 5d⁴ | Hoher Schmelzpunkt; WO₃. |
| Rhenium | Re (Z = 75) | n = 6 | 7 | 6s² 4f¹⁴ 5d⁵ | Katalysator; Re₂O₇. |
| Osmium | Os (Z = 76) | n = 6 | 8 | 6s² 4f¹⁴ 5d⁶ | Sehr dicht; OsO₄. |
| Iridium | Ir (Z = 77) | n = 6 | 9 | 6s² 4f¹⁴ 5d⁷ | Resistent; IrO₂. |
| Platin | Pt (Z = 78) | n = 6 | 10 | 6s¹ 4f¹⁴ 5d⁹ | Katalysator; PtO₂. |
| Gold | Au (Z = 79) | n = 6 | 1 | 6s¹ 4f¹⁴ 5d¹⁰ | Edel; Au₂O₃. |
| Quecksilber | Hg (Z = 80) | n = 6 | 2 | 6s² 4f¹⁴ 5d¹⁰ | Flüssig; HgO. |
| Thallium | Tl (Z = 81) | n = 6 | 3 | 6s² 6p¹ | Giftig; Tl₂O. |
| Blei | Pb (Z = 82) | n = 6 | 4 | 6s² 6p² | Metallische Bindungen; PbO. |
| Wismut | Bi (Z = 83) | n = 6 | 5 | 6s² 6p³ | Halbmetall; Bi₂O₃. |
| Polonium | Po (Z = 84) | n = 6 | 6 | 6s² 6p⁴ | Radioaktiv; PoO₂. |
| Astat | At (Z = 85) | n = 6 | 7 | 6s² 6p⁵ | Radioaktiv; seltenes Halogen. |
| Radon | Rn (Z = 86) | n = 6 | 8 | 6s² 6p⁶ | Radioaktives Edelgas. |
| Francium | Fr (Z = 87) | n = 7 | 1 | 7s¹ | Radioaktiv; Alkalimetall. |
| Radium | Ra (Z = 88) | n = 7 | 2 | 7s² | Radioaktiv; RaO. |
| Actinium | Ac (Z = 89) | n = 7 | 3 | 7s² 6d¹ | Actinid; Ac₂O₃. |
| Thorium | Th (Z = 90) | n = 7 | 4 | 7s² 6d² | Actinid; ThO₂. |
| Protactinium | Pa (Z = 91) | n = 7 | 5 | 7s² 5f² 6d¹ | Radioaktiv; Pa₂O₅. |
| Uran | U (Z = 92) | n = 7 | 3–6 | 7s² 6d¹ 5f³ | Komplexe Bindungen mit O (UO₂²⁺), F (UF₆). |