Para describir la distribución de los electrones alrededor del núcleo atómico, los físicos utilizan una notación histórica simple: las capas electrónicas K, L, M, N, O, P y Q. Esta notación fue introducida a principios del siglo XX por el físico Charles Barkla (1877-1944) durante el estudio de los rayos X. Esta notación permite visualizar rápidamente cómo se distribuyen los electrones por niveles de energía crecientes, desde la capa más cercana al núcleo (K) hasta las capas externas.
Cada letra corresponde a un número cuántico principal n:
Capa K: n = 1 (primera capa, la más cercana al núcleo)
Capa L: n = 2 (segunda capa)
Capa M: n = 3 (tercera capa)
Capa N: n = 4 (cuarta capa)
Capa O: n = 5 (quinta capa)
Capa P: n = 6 (sexta capa)
Capa Q: n = 7 (séptima capa)
Cada capa puede contener un número máximo de electrones definido por la fórmula 2n²:
Capa K (n=1): máximo 2 electrones (2 × 1² = 2)
Capa L (n=2): máximo 8 electrones (2 × 2² = 8)
Capa M (n=3): máximo 18 electrones (2 × 3² = 18)
Capa N (n=4): máximo 32 electrones (2 × 4² = 32) → El uranio lo alcanza: K(2) L(8) M(18) N(32)
Capa O (n=5): máximo 50 electrones (2 × 5² = 50) → Nunca alcanzado (el uranio solo tiene 21 electrones en O)
Capa P (n=6): máximo 72 electrones (2 × 6² = 72) → Nunca alcanzado
Capa Q (n=7): máximo 98 electrones (2 × 7² = 98) → Nunca alcanzado
N.B.:
En la práctica, ningún elemento conocido llena completamente las capas más allá de N. El elemento natural más pesado, el uranio (Z=92), tiene la configuración K(2) L(8) M(18) N(32) O(21) P(9) Q(2). El elemento sintético más pesado confirmado, el oganesón (Z=118), tiene la configuración K(2) L(8) M(18) N(32) O(32) P(18) Q(8).
Cada capa está dividida en subcapas designadas por las letras s, p, d, f:
Subcapa s: puede contener hasta 2 electrones (1 orbital)
Subcapa p: puede contener hasta 6 electrones (3 orbitales)
Subcapa d: puede contener hasta 10 electrones (5 orbitales)
Subcapa f: puede contener hasta 14 electrones (7 orbitales)
Capa K (n=1): contiene solo 1s (2 electrones máx.)
Capa L (n=2): contiene 2s y 2p (2 + 6 = 8 electrones máx.)
Capa M (n=3): contiene 3s, 3p y 3d (2 + 6 + 10 = 18 electrones máx.)
Capa N (n=4): contiene 4s, 4p, 4d y 4f (2 + 6 + 10 + 14 = 32 electrones máx.)
Capa O (n=5): contiene 5s, 5p, 5d y 5f (2 + 6 + 10 + 14 = 32 electrones máx. teóricos, aunque la subcapa 5g teórica no existe en los elementos conocidos)
Capa P (n=6): contiene 6s, 6p, 6d y 6f (2 + 6 + 10 + 14 = 32 electrones máx. para las subcapas conocidas)
Capa Q (n=7): contiene 7s, 7p y potencialmente 7d (solo se observan electrones 7s y 7p en los elementos conocidos)
Esta notación indica el número total de electrones presentes en cada capa, sin detallar las subcapas. Es particularmente útil para visualizar rápidamente la distribución electrónica global de un átomo.
Helio (2 electrones): 1s² → K(2)
La capa K está completa y saturada.
Neón (10 electrones): 1s² 2s² 2p⁶ → K(2) L(8)
Las capas K y L están completas y saturadas.
Sodio (11 electrones): 1s² 2s² 2p⁶ 3s¹ → K(2) L(8) M(1)
Las capas K y L están completas, la capa M contiene solo 1 electrón de 18 posibles.
Argón (18 electrones): 1s² 2s² 2p⁶ 3s² 3p⁶ → K(2) L(8) M(8)
Las capas K y L están completas. La capa M contiene 8 electrones pero no está completa (las subcapas 3s y 3p están saturadas, pero 3d permanece vacía).
Calcio (20 electrones): 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² → K(2) L(8) M(8) N(2)
Observe que la subcapa 4s se llena antes que la 3d, lo que explica por qué la capa M permanece con 8 electrones.
Titanio (22 electrones): 1s² 2s² 2p⁶ 3s² 3p⁶ 3d² 4s² → K(2) L(8) M(10) N(2)
La capa M comienza a llenarse con los electrones 3d.
El orden de llenado no sigue estrictamente el orden de las capas K, L, M, N… debido a los niveles de energía de las subcapas. El orden general es:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d…
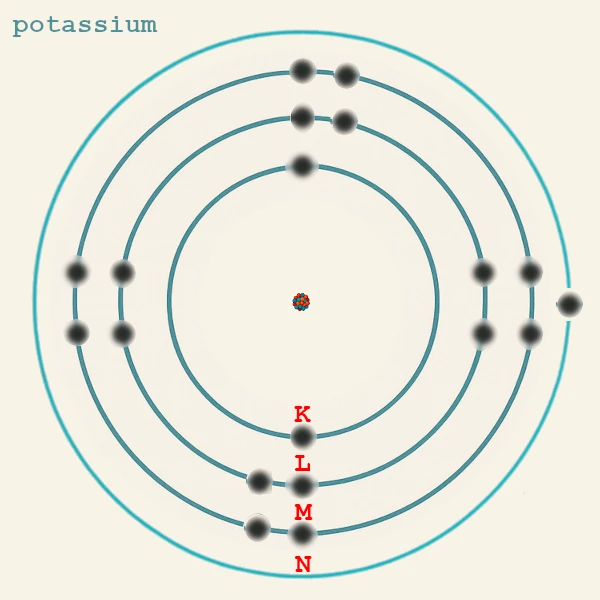
Este principio explica por qué, por ejemplo, el potasio (19 electrones) tiene la configuración K(2) L(8) M(8) N(1): el electrón 19 va a 4s en lugar de 3d porque la subcapa 4s tiene menor energía que 3d.
La notación K, L, M, N, O, P, Q permite:
• Visualizar rápidamente la estructura electrónica global de un átomo
• Identificar fácilmente la capa de valencia (capa externa)
• Comprender las propiedades químicas relacionadas con los electrones de valencia
• Explicar la clasificación de los elementos en la tabla periódica
• Predecir los estados de oxidación y la reactividad química de los elementos
La reactividad química de los elementos tiene su origen en su estructura electrónica, en particular en la configuración de su capa de valencia. La capa externa, o capa de valencia, determina la capacidad de un elemento para formar enlaces químicos: los átomos tienden a ganar, perder o compartir electrones para alcanzar una configuración estable, generalmente la del gas noble más cercano.
Esta tendencia explica las afinidades químicas observadas: los metales alcalinos, con un solo electrón de valencia, lo ceden fácilmente para formar cationes; los halógenos, a los que les falta un electrón para completar su capa externa, son ávidos de electrones y forman aniones; mientras que los gases nobles, con su capa de valencia completa, permanecen químicamente inertes. Entre estos extremos, los elementos de transición y los metaloides presentan comportamientos intermedios, pudiendo formar varios tipos de enlaces según las condiciones.
La comprensión de estas relaciones estructura-propiedad constituye la base de la química moderna y permite predecir el comportamiento de los elementos en las reacciones químicas.
| Elemento | Símbolo (Z) | Capa de valencia | Electrones de valencia | Configuración de valencia | Afinidad con otros elementos (ejemplos) |
|---|---|---|---|---|---|
| Hidrógeno | H (Z = 1) | n = 1 | 1 | 1s¹ | Enlaces covalentes con O (H₂O), C (CH₄), N (NH₃). |
| Helio | He (Z = 2) | n = 1 | 2 | 1s² | Afinidad química casi nula; gas noble inerte. |
| Litio | Li (Z = 3) | n = 2 | 1 | 2s¹ | Enlaces iónicos con F (LiF), O (Li₂O). |
| Berilio | Be (Z = 4) | n = 2 | 2 | 2s² | Enlaces covalentes con O (BeO), C (Be₂C). |
| Boro | B (Z = 5) | n = 2 | 3 | 2s² 2p¹ | Enlaces deficientes con F (BF₃), H (boranos). |
| Carbono | C (Z = 6) | n = 2 | 4 | 2s² 2p² | Enlaces covalentes con H, O (CO₂), N. |
| Nitrógeno | N (Z = 7) | n = 2 | 5 | 2s² 2p³ | Enlaces múltiples con H (NH₃), C (CN⁻). |
| Oxígeno | O (Z = 8) | n = 2 | 6 | 2s² 2p⁴ | Principal oxidante; enlaces con H, C, metales. |
| Flúor | F (Z = 9) | n = 2 | 7 | 2s² 2p⁵ | Muy alta electronegatividad; enlaces iónicos. |
| Neón | Ne (Z = 10) | n = 2 | 8 | 2s² 2p⁶ | Gas noble inerte. |
| Sodio | Na (Z = 11) | n = 3 | 1 | 3s¹ | Enlaces iónicos con Cl (NaCl), O. |
| Magnesio | Mg (Z = 12) | n = 3 | 2 | 3s² | Enlaces iónicos con O (MgO). |
| Aluminio | Al (Z = 13) | n = 3 | 3 | 3s² 3p¹ | Enlaces metálicos y covalentes (Al₂O₃). |
| Silicio | Si (Z = 14) | n = 3 | 4 | 3s² 3p² | Redes covalentes (SiO₂). |
| Fósforo | P (Z = 15) | n = 3 | 5 | 3s² 3p³ | Enlaces con O (PO₄³⁻), H. |
| Azufre | S (Z = 16) | n = 3 | 6 | 3s² 3p⁴ | Enlaces con H (H₂S), O (SO₂). |
| Cloro | Cl (Z = 17) | n = 3 | 7 | 3s² 3p⁵ | Enlaces iónicos con Na, covalentes con H. |
| Argón | Ar (Z = 18) | n = 3 | 8 | 3s² 3p⁶ | Gas noble inerte. |
| Potasio | K (Z = 19) | n = 4 | 1 | 4s¹ | Enlaces iónicos con Cl (KCl), O. |
| Calcio | Ca (Z = 20) | n = 4 | 2 | 4s² | Enlaces iónicos con O (CaO), carbonatos. |
| Escandio | Sc (Z = 21) | n = 4 | 3 | 4s² 3d¹ | Enlaces metálicos; óxidos Sc₂O₃. |
| Titanio | Ti (Z = 22) | n = 4 | 4 | 4s² 3d² | Enlaces metálicos; óxidos TiO₂. |
| Vanadio | V (Z = 23) | n = 4 | 5 | 4s² 3d³ | Estados de oxidación múltiples; V₂O₅. |
| Cromo | Cr (Z = 24) | n = 4 | 6 | 4s¹ 3d⁵ | Enlaces metálicos; óxidos Cr₂O₃. |
| Manganeso | Mn (Z = 25) | n = 4 | 7 | 4s² 3d⁵ | Estados de oxidación variados; MnO₂. |
| Hierro | Fe (Z = 26) | n = 4 | 2–3 | 4s² 3d⁶ | Enlaces metálicos; óxidos Fe₂O₃. |
| Cobalto | Co (Z = 27) | n = 4 | 2–3 | 4s² 3d⁷ | Enlaces metálicos; complejos CoO. |
| Níquel | Ni (Z = 28) | n = 4 | 2 | 4s² 3d⁸ | Enlaces metálicos; catalizador NiO. |
| Cobre | Cu (Z = 29) | n = 4 | 1–2 | 4s¹ 3d¹⁰ | Enlaces metálicos; óxidos CuO. |
| Zinc | Zn (Z = 30) | n = 4 | 2 | 4s² 3d¹⁰ | Enlaces iónicos con O, S. |
| Galio | Ga (Z = 31) | n = 4 | 3 | 4s² 4p¹ | Enlaces metálicos; semiconductores GaAs. |
| Germanio | Ge (Z = 32) | n = 4 | 4 | 4s² 4p² | Semiconductor; enlaces covalentes GeO₂. |
| Arsénico | As (Z = 33) | n = 4 | 5 | 4s² 4p³ | Enlaces covalentes con S, O. |
| Selenio | Se (Z = 34) | n = 4 | 6 | 4s² 4p⁴ | Análogo al azufre; H₂Se. |
| Bromo | Br (Z = 35) | n = 4 | 7 | 4s² 4p⁵ | Halógeno; enlaces con H, metales. |
| Criptón | Kr (Z = 36) | n = 4 | 8 | 4s² 4p⁶ | Gas noble casi inerte. |
| Rubidio | Rb (Z = 37) | n = 5 | 1 | 5s¹ | Metal alcalino; enlaces iónicos RbCl. |
| Estroncio | Sr (Z = 38) | n = 5 | 2 | 5s² | Enlaces iónicos con O (SrO). |
| Itrio | Y (Z = 39) | n = 5 | 3 | 5s² 4d¹ | Metal de transición; Y₂O₃. |
| Circonio | Zr (Z = 40) | n = 5 | 4 | 5s² 4d² | Enlaces metálicos; ZrO₂. |
| Niobio | Nb (Z = 41) | n = 5 | 5 | 5s¹ 4d⁴ | Superconductor; Nb₂O₅. |
| Molibdeno | Mo (Z = 42) | n = 5 | 6 | 5s¹ 4d⁵ | Enlaces metálicos; MoS₂. |
| Tecnecio | Tc (Z = 43) | n = 5 | 7 | 5s² 4d⁵ | Radiactivo; complejos con O. |
| Rutenio | Ru (Z = 44) | n = 5 | 8 | 5s¹ 4d⁷ | Catalizador; RuO₂. |
| Rodio | Rh (Z = 45) | n = 5 | 9 | 5s¹ 4d⁸ | Catalizador; Rh₂O₃. |
| Paladio | Pd (Z = 46) | n = 5 | 10 | 4d¹⁰ | Catalizador; PdO. |
| Plata | Ag (Z = 47) | n = 5 | 1 | 5s¹ 4d¹⁰ | Enlaces metálicos; Ag₂O. |
| Cadmio | Cd (Z = 48) | n = 5 | 2 | 5s² 4d¹⁰ | Enlaces iónicos; CdS. |
| Indio | In (Z = 49) | n = 5 | 3 | 5s² 5p¹ | Semiconductor; In₂O₃. |
| Estaño | Sn (Z = 50) | n = 5 | 4 | 5s² 5p² | Enlaces metálicos; SnO₂. |
| Antimonio | Sb (Z = 51) | n = 5 | 5 | 5s² 5p³ | Semimetal; Sb₂O₃. |
| Telurio | Te (Z = 52) | n = 5 | 6 | 5s² 5p⁴ | Semimetal; H₂Te. |
| Yodo | I (Z = 53) | n = 5 | 7 | 5s² 5p⁵ | Halógeno; enlaces con H, metales. |
| Xenón | Xe (Z = 54) | n = 5 | 8 | 5s² 5p⁶ | Gas noble; compuestos con F (XeF₄). |
| Cesio | Cs (Z = 55) | n = 6 | 1 | 6s¹ | Metal alcalino muy reactivo; CsCl. |
| Bario | Ba (Z = 56) | n = 6 | 2 | 6s² | Enlaces iónicos; BaO. |
| Lantano | La (Z = 57) | n = 6 | 3 | 6s² 5d¹ | Lantánido; La₂O₃. |
| Cerio | Ce (Z = 58) | n = 6 | 3–4 | 6s² 4f¹ 5d¹ | Lantánido; CeO₂. |
| Praseodimio | Pr (Z = 59) | n = 6 | 3 | 6s² 4f³ | Lantánido; Pr₂O₃. |
| Neodimio | Nd (Z = 60) | n = 6 | 3 | 6s² 4f⁴ | Imán potente; Nd₂O₃. |
| Prometio | Pm (Z = 61) | n = 6 | 3 | 6s² 4f⁵ | Radiactivo; Pm₂O₃. |
| Samario | Sm (Z = 62) | n = 6 | 2–3 | 6s² 4f⁶ | Imán; Sm₂O₃. |
| Europio | Eu (Z = 63) | n = 6 | 2–3 | 6s² 4f⁷ | Fósforo; Eu₂O₃. |
| Gadolinio | Gd (Z = 64) | n = 6 | 3 | 6s² 4f⁷ 5d¹ | Magnético; Gd₂O₃. |
| Terbio | Tb (Z = 65) | n = 6 | 3 | 6s² 4f⁹ | Fósforo; Tb₂O₃. |
| Disprosio | Dy (Z = 66) | n = 6 | 3 | 6s² 4f¹⁰ | Imán; Dy₂O₃. |
| Holmio | Ho (Z = 67) | n = 6 | 3 | 6s² 4f¹¹ | Magnético; Ho₂O₃. |
| Erbio | Er (Z = 68) | n = 6 | 3 | 6s² 4f¹² | Óptica; Er₂O₃. |
| Tulio | Tm (Z = 69) | n = 6 | 3 | 6s² 4f¹³ | Láser; Tm₂O₃. |
| Iterbio | Yb (Z = 70) | n = 6 | 2–3 | 6s² 4f¹⁴ | Yb₂O₃. |
| Lutecio | Lu (Z = 71) | n = 6 | 3 | 6s² 4f¹⁴ 5d¹ | Lu₂O₃. |
| Hafnio | Hf (Z = 72) | n = 6 | 4 | 6s² 4f¹⁴ 5d² | Enlaces metálicos; HfO₂. |
| Tántalo | Ta (Z = 73) | n = 6 | 5 | 6s² 4f¹⁴ 5d³ | Resistente; Ta₂O₅. |
| Tungsteno | W (Z = 74) | n = 6 | 6 | 6s² 4f¹⁴ 5d⁴ | Punto de fusión elevado; WO₃. |
| Renio | Re (Z = 75) | n = 6 | 7 | 6s² 4f¹⁴ 5d⁵ | Catalizador; Re₂O₇. |
| Osmio | Os (Z = 76) | n = 6 | 8 | 6s² 4f¹⁴ 5d⁶ | Muy denso; OsO₄. |
| Iridio | Ir (Z = 77) | n = 6 | 9 | 6s² 4f¹⁴ 5d⁷ | Resistente; IrO₂. |
| Platino | Pt (Z = 78) | n = 6 | 10 | 6s¹ 4f¹⁴ 5d⁹ | Catalizador; PtO₂. |
| Oro | Au (Z = 79) | n = 6 | 1 | 6s¹ 4f¹⁴ 5d¹⁰ | Noble; Au₂O₃. |
| Mercurio | Hg (Z = 80) | n = 6 | 2 | 6s² 4f¹⁴ 5d¹⁰ | Líquido; HgO. |
| Talio | Tl (Z = 81) | n = 6 | 3 | 6s² 6p¹ | Tóxico; Tl₂O. |
| Plomo | Pb (Z = 82) | n = 6 | 4 | 6s² 6p² | Enlaces metálicos; PbO. |
| Bismuto | Bi (Z = 83) | n = 6 | 5 | 6s² 6p³ | Semimetal; Bi₂O₃. |
| Polonio | Po (Z = 84) | n = 6 | 6 | 6s² 6p⁴ | Radiactivo; PoO₂. |
| Ástato | At (Z = 85) | n = 6 | 7 | 6s² 6p⁵ | Radiactivo; halógeno raro. |
| Radón | Rn (Z = 86) | n = 6 | 8 | 6s² 6p⁶ | Gas noble radiactivo. |
| Francio | Fr (Z = 87) | n = 7 | 1 | 7s¹ | Radiactivo; metal alcalino. |
| Radio | Ra (Z = 88) | n = 7 | 2 | 7s² | Radiactivo; RaO. |
| Actinio | Ac (Z = 89) | n = 7 | 3 | 7s² 6d¹ | Actínido; Ac₂O₃. |
| Torio | Th (Z = 90) | n = 7 | 4 | 7s² 6d² | Actínido; ThO₂. |
| Protactinio | Pa (Z = 91) | n = 7 | 5 | 7s² 5f² 6d¹ | Radiactivo; Pa₂O₅. |
| Uranio | U (Z = 92) | n = 7 | 3–6 | 7s² 6d¹ 5f³ | Enlaces complejos con O (UO₂²⁺), F (UF₆). |