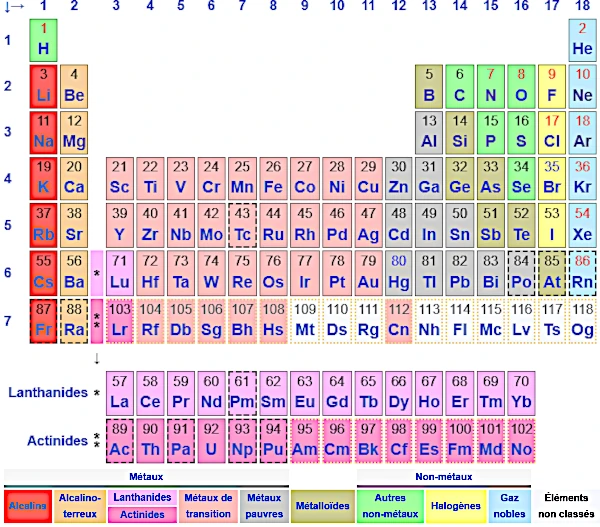
A Tabela Periódica dos Elementos Químicos, uma das ferramentas mais importantes na química, foi desenvolvida por Dmitri Mendeleev (1834-1907) em 1869. Sua versão original classificava os 63 elementos conhecidos na época por massa atômica crescente e destacava a periodicidade de suas propriedades químicas. A grande inovação de Mendeleev foi deixar espaços em branco para elementos desconhecidos em sua época, cujas propriedades ele previu com notável precisão.
| Elemento | Símbolo | N° Atômico | Descoberta | Usos Modernos |
|---|---|---|---|---|
| Hélio | He | 2 | 1868 (espectroscopia solar) | Balões, ressonância magnética, soldagem |
| Gálio | Ga | 31 | 1875 | Semicondutores (chips eletrônicos) |
| Germânio | Ge | 32 | 1886 | Fibras ópticas, lentes infravermelhas |
| Rádio | Ra | 88 | 1898 (Pierre e Marie Curie) | Antigamente na medicina (radioterapia) |
| Neônio | Ne | 10 | 1898 | Iluminação (letreiros luminosos) |
| Plutônio | Pu | 94 | 1940 | Energia nuclear (civil e militar) |
| Tecnécio | Tc | 43 | 1937 (1º elemento artificial) | Medicina nuclear (scanners) |
| Frâncio | Fr | 87 | 1939 | Pesquisa fundamental (muito raro) |
| Urânio | U | 92 | 1789 (mas propriedades desconhecidas) | Usinas nucleares, armamentos |
| Platina | Pt | 78 | Conhecido mas não estudado | Catalisadores automotivos, joalheria |
Mendeleev havia previsto com notável precisão as propriedades do gálio (que ele chamava de "eka-alumínio"), do germânio ("eka-silício") e do escândio ("eka-boro"). Essas descobertas posteriores validaram sua tabela periódica.
A tabela moderna organiza os 118 elementos conhecidos (até o momento) de acordo com seu número atômico (número de prótons) e suas propriedades químicas recorrentes. Ela é composta por:
Os elementos são classificados em três grandes categorias:
Certos grupos têm propriedades químicas particularmente semelhantes:
Os elementos além do urânio (número atômico > 92) são geralmente sintéticos, produzidos em laboratório. Eles são frequentemente muito instáveis e se desintegram rapidamente pela radioatividade.