La demi-vie ou période radioactive d’un isotope radioactif est le temps nécessaire pour que la moitié des noyaux d’un échantillon se désintègre. C’est une grandeur caractéristique d’un noyau instable et une mesure probabiliste de sa stabilité. La demi-vie est indépendante de la quantité de matière ou des conditions extérieures (température, pression, etc.) car la désintégration radioactive est un processus purement quantique, gouverné par les lois de la mécanique quantique.
Une courte demi-vie signifie une désintégration rapide (élément très instable). Une longue demi-vie indique un élément plus stable.
Non, tous les éléments chimiques n’ont pas une demi-vie mesurable, car certains isotopes sont stables. Par exemple, le carbone-12 (12C), l’oxygène-16 (16O) ou encore le fer-56 (56Fe) ne se désintègrent pas spontanément, même sur des échelles de temps comparables à l’âge de l’Univers. En revanche, les éléments radioactifs comme l’uranium, le thorium ou le polonium possèdent une ou plusieurs formes instables (isotopes) avec des demi-vies variant de microsecondes à des milliards d’années.
La période radioactive, souvent notée \( T_{1/2} \)) d’un élément chimique (ou plus précisément d’un nucléide radioactif) est donc le temps nécessaire pour que la moitié des noyaux d’un échantillon donné se désintègrent spontanément. Elle est une mesure de la stabilité nucléaire.
Pour un échantillon contenant \( N_0 \) noyaux au temps \( t = 0 \), la loi de décroissance radioactive est : \( N(t) = N_0 \cdot e^{-\lambda t} \)
La demi-vie \( T_{1/2} \) est reliée à \( \lambda \) par : \( T_{1/2} = \frac{\ln(2)}{\lambda} \)
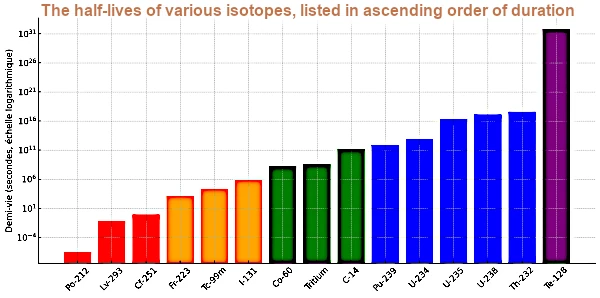
| Élément | Isotope | Demi-vie (secondes) | Demi-vie (forme lisible) |
|---|---|---|---|
| Polonium | Po-212 | 0.0000003 | 0.3 µs |
| Livermorium | Lv-293 | 0.061 | 61 ms |
| Californium | Cf-251 | 0.9 | 0.9 s |
| Francium | Fr-223 | 1320 | 22 min |
| Technetium | Tc-99m | 21600 | 6 h |
| Iode | I-131 | 693,728 | 8.02 j |
| Cobalt | Co-60 | 166,824,000 | 5.27 ans |
| Hydrogène | Tritium | 388,435,680 | 12.32 ans |
| Carbone | C-14 | 180,622,080,000 | 5730 ans |
| Plutonium | Pu-239 | 760,585,760,000 | 24 100 ans |
| Uranium | U-234 | 7,740,138,000,000 | 245 500 ans |
| Uranium | U-235 | 22,174,070,000,000 | 703 millions d'années |
| Uranium | U-238 | 141,379,620,000,000 | 4.468 milliards d'années |
| Thorium | Th-232 | 443,538,150,000,000 | 14.05 milliards d'années |
| Tellure | Te-128 | 6.945×10²⁴ | 2.2×10²⁴ s (~7×10¹⁶ ans) |
Ce graphique montre les demi-vies des isotopes sélectionnés, classées par ordre croissant. L’échelle logarithmique permet de visualiser les écarts gigantesques, allant de la microseconde à plus de 10²⁴ secondes.