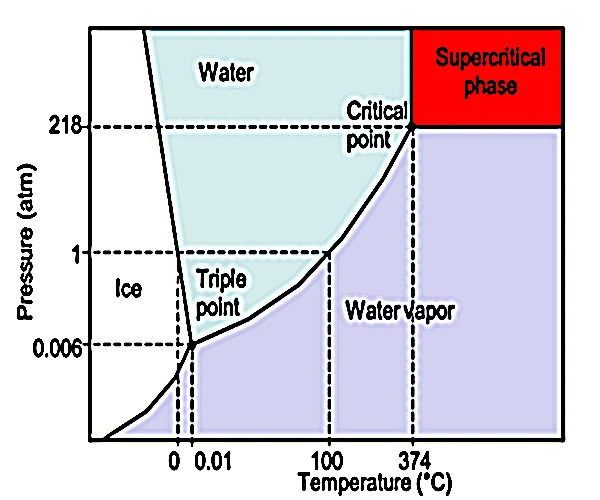
Der überkritische Zustand von Wasser wird bei einer Temperatur von erreicht374°Cund ein Druck von22,06 MPa(≈217,8 atm) ist ein thermodynamischer Bereich, in dem Wasser nicht mehr zwischen Flüssigkeit und Gas unterschieden wird. In dieser Zone hat es sowohl die Dichte einer Flüssigkeit als auch die Diffusionsfähigkeit eines Gases. Dieses hybride Verhalten ebnet den Weg für einzigartige physikalische und chemische Eigenschaften, wodurch es hochreaktiv ist, sich hervorragend zum Auflösen organischer und anorganischer Substanzen eignet und in der Geochemie, in industriellen Prozessen und sogar bei der Erforschung präbiotischer Bedingungen weit verbreitet ist.
Im Gegensatz zu flüssigem oder dampfförmigem Wasser weist überkritisches Wasser erhebliche Dichteschwankungen im kleinen Maßstab auf, die die Dielektrizitätskonstanten, die Ionensolvatisierung und die Wärmetransportmechanismen verändern. Es kann Salze wie eine Flüssigkeit lösen, verhält sich jedoch bei unpolaren Spezies wie ein Gas. Seine Wärmeleitfähigkeit ist hoch, seine Viskosität niedrig und seine Oberflächenspannung ist Null. Diese Eigenschaften machen es zu einem hervorragenden Arbeitsmedium oder umweltfreundlichen Lösungsmittel in nachhaltigen Chemieprozessen.
Der überkritische Zustand von Wasser kann nur bei Drücken größer als vorliegen217 Geldautomatenund Temperaturen darüber374°C. Diese Bedingungen sind in bestimmten tiefen geothermischen Umgebungen natürlicherweise gegeben, insbesondere in derozeanische Krusteund in der NäheMagmakammern. Sie finden sich insbesondere in folgenden Bereichen:
Diese extremen Umgebungen sind sowohl für die Grundlagenforschung (Ursprung des Lebens, Extremophile, Mineralisierung) als auch für neue Geoenergietechnologien von großem Interesse.
Überkritisches Wasser kommt in verschiedenen Bereichen vor:
Der überkritische Zustand des Wassers könnte bei der Entstehung des Lebens auf der Erde eine Rolle gespielt haben. In tiefen hydrothermalen Umgebungen hätte überkritisches Wasser komplexe organische Reaktionen begünstigt, Vorläufer für die Entstehung der ersten biologischen Moleküle. Darüber hinaus könnten die außergewöhnlichen Solvatisierungs- und Katalyseeigenschaften als Unterstützung für die Entwicklung präbiotischer Chemie an der Oberfläche oder in der Erdkruste dienen.
| Eigentum | Flüssig | Dampf | Überkritisch |
|---|---|---|---|
| Dichte (kg/m³) | 1000 | 0,6 | 200-500 |
| Viskosität (μPa·s) | 890 | 13 | 100-300 |
| Dielektrizitätskonstante | ≈80 | ≈1,0 | ≈10-20 |
| Löslichkeit von Salzen | Stärke | Null | Mittel bis stark (variabel) |
| Oberflächenspannung | 72 mN/m | Null | Null |
Quelle :NIST-Chemie-WebBook, ScienceDirect – Überkritische Wasseroxidation.