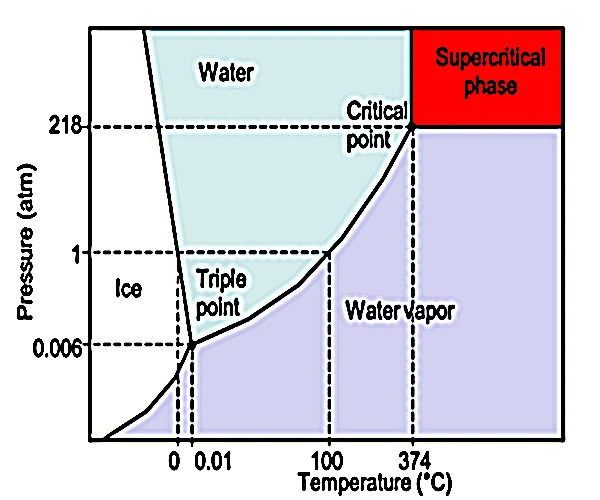
El estado supercrítico del agua, alcanzado a una temperatura de 374 °C y una presión de 22.06 MPa (≈217.8 atm), es un dominio termodinámico en el que el agua ya no se distingue entre líquido y gas. En esta zona, tiene tanto la densidad de un líquido como la difusividad de un gas. Este comportamiento híbrido da lugar a propiedades físicas y químicas únicas, haciéndola muy reactiva, excelente para disolver sustancias orgánicas e inorgánicas, y ampliamente utilizada en geoquímica, procesos industriales e incluso en la exploración de condiciones prebióticas.
A diferencia del agua líquida o del vapor, el agua supercrítica presenta fluctuaciones significativas de densidad a pequeña escala, lo que modifica las constantes dieléctricas, la solvatación iónica y los mecanismos de transporte térmico. Puede disolver sales como un líquido pero comportarse como un gas para especies no polares. Su conductividad térmica es alta, su viscosidad baja y su tensión superficial es nula. Estas características la convierten en un excelente fluido de trabajo o disolvente verde en procesos de química sostenible.
El estado supercrítico del agua solo puede existir a presiones superiores a 217 atm y temperaturas superiores a 374 °C. Estas condiciones se encuentran naturalmente en ciertos entornos geotérmicos profundos, particularmente en la corteza oceánica y cerca de cámaras magmáticas. Se puede encontrar en las siguientes áreas:
Estos entornos extremos son de gran interés tanto para la investigación fundamental (origen de la vida, extremófilos, mineralización) como para las tecnologías emergentes de geoenergía.
El agua supercrítica se encuentra en diversos campos:
El estado supercrítico del agua podría haber desempeñado un papel en el origen de la vida en la Tierra. En entornos hidrotermales profundos, el agua supercrítica podría haber favorecido reacciones orgánicas complejas, precursoras de la aparición de las primeras moléculas biológicas. Además, las excepcionales propiedades de solvatación y catálisis podrían haber servido de soporte al desarrollo de químicas prebióticas en la superficie o en la corteza terrestre.
| Propiedad | Líquido | Vapor | Supercrítico |
|---|---|---|---|
| Densidad (kg/m³) | 1000 | 0.6 | 200-500 |
| Viscosidad (μPa·s) | 890 | 13 | 100-300 |
| Constante dieléctrica | ≈80 | ≈1.0 | ≈10-20 |
| Solubilidad de sales | Fuerte | Nula | Media a fuerte (variable) |
| Tensión superficial | 72 mN/m | Nula | Nula |
Fuente: NIST Chemistry WebBook, ScienceDirect - Supercritical water oxidation.