En la antigüedad, la escuela atomista fue uno de los primeros intentos de comprender la naturaleza de la materia a través de corpúsculos llamados 'atomos' (indivisibles).
Dos filósofos griegos de la escuela atomista, Leucipo (500 - 440 a.C.) y Demócrito (460 - 370 a.C.) pensaban que toda la materia estaba compuesta de corpúsculos diminutos, en movimiento perpetuo, muy sólidos y eternos.
Su concepción de los átomos era una abstracción filosófica basada en la lógica: si imaginamos cortar continuamente un objeto, ¿podemos dividirlo infinitamente?
Demócrito pensaba que los átomos diferían en forma, tamaño, posición y orientación. Por ejemplo, imaginaba que los átomos que componen los líquidos serían lisos y redondos para deslizarse fácilmente unos sobre otros, mientras que los de los sólidos serían rugosos y con ganchos para entrelazarse.
En la escuela atomista de Leucipo y Demócrito, el átomo está en movimiento rectilíneo perpetuo en el vacío, influenciado por el clinamen. El clinamen es una ligera desviación aleatoria del movimiento de los átomos que permite la emergencia de la diversidad en el mundo material.
Durante la Edad Media, las ideas atomistas de Leucipo, Demócrito y Epicuro fueron ampliamente rechazadas por los filósofos y teólogos. Este período estuvo dominado por la visión aristotélica de la materia.
Aristóteles (siglo IV a.C.) rechazaba la idea de los átomos y el vacío. Proponía que toda la materia estaba compuesta de cuatro elementos fundamentales: tierra, agua, aire y fuego, asociados a cualidades (caliente, frío, seco, húmedo). La materia era considerada continua, sin corpúsculos indivisibles.
En la Edad Media, el movimiento de los átomos no existía realmente en el discurso filosófico. El movimiento era generalmente visto como una transformación de los elementos según cualidades internas o influencias externas.
En 1911, el experimento de Ernest Rutherford (1871-1937) revolucionó nuestra comprensión del átomo al demostrar la existencia de un núcleo central denso.
Rutherford propuso un modelo del átomo, también conocido como modelo planetario, donde un núcleo central denso y masivo, cargado positivamente, contiene casi toda la masa del átomo.
Electrones ligeros orbitan alrededor del núcleo a cierta distancia, en lo que se puede comparar con una órbita, aunque su movimiento exacto aún no está bien definido.
N.B.:
Rutherford desarrolló su modelo utilizando una fina lámina de oro bombardeada por partículas alfa (núcleos de helio). La mayoría de las partículas pasan sin desviación, mostrando que el átomo es mayoritariamente vacío. Algunas partículas se desvían fuertemente y algunas rebotan casi directamente, demostrando la presencia de un núcleo denso y positivo.
El modelo de Rutherford tiene una visión simplificada del movimiento de los electrones alrededor del núcleo. Es estable, circular y dictado por la fuerza electrostática de atracción entre el núcleo y los electrones. Este modelo no explica por qué los electrones no pierden energía y caen en el núcleo (lo que predice la física clásica).
En 1913, el modelo de Niels Bohr (1885-1962) introdujo la cuantización de las órbitas electrónicas, marcando un paso crucial en la comprensión del átomo.
Niels Bohr representa una etapa fundamental en la historia de la física atómica, ya que introdujo una descripción cuantificada del movimiento de los electrones en un átomo, basándose en la mecánica clásica y las primeras ideas de la mecánica cuántica.
Lo que distingue el modelo de Bohr de las teorías clásicas es la idea de que solo ciertas órbitas están permitidas. Estas órbitas están cuantificadas, lo que significa que los electrones solo pueden ocupar niveles de energía específicos. Los electrones emiten o absorben una cantidad bien definida de energía, en forma de cuantos de luz, durante las transiciones entre órbitas.
El modelo de Bohr explicó con éxito fenómenos como la espectroscopia del hidrógeno, mostrando que las líneas espectrales se deben a transiciones entre niveles de energía cuantificados. Desafortunadamente, este modelo solo funciona bien para el hidrógeno (un solo electrón) y falla para átomos más complejos. No explica los espectros de átomos multi-electrónicos.
Bohr supone que los electrones se mueven en órbitas circulares alrededor del núcleo. Cada órbita corresponde a un nivel de energía específico. Durante este movimiento, no ocurre nada, a diferencia de la mecánica clásica, donde un electrón en movimiento alrededor del núcleo debería perder energía y colapsar en el núcleo.
El modelo de Bohr postula que los electrones en órbitas estables no pierden energía y permanecen en estas órbitas sin colapsar. Sin embargo, los electrones pueden pasar de un nivel de energía a otro absorbiendo o emitiendo cuantos de energía (lo que hoy llamamos un fotón). Los saltos cuánticos no se consideran movimientos continuos.
En 1924, la teoría de De Broglie (1892-1987) introdujo la dualidad onda-partícula, una noción fundamental de la mecánica cuántica.
La idea central de la teoría de De Broglie es que si la luz se comporta como una onda y un corpúsculo, entonces cualquier partícula material (como los electrones) puede comportarse tanto como una onda como un corpúsculo, un concepto conocido como dualidad onda-partícula.
Las partículas masivas, como los electrones, poseen una longitud de onda asociada llamada longitud de onda de De Broglie. El modelo de De Broglie proporciona una justificación física basada en la dualidad onda-partícula.
De Broglie sugiere que los electrones que orbitan el núcleo deben considerarse no como partículas puntuales siguiendo trayectorias circulares clásicas, sino como ondas estacionarias, y sus posiciones probables están distribuidas de manera que correspondan a interferencias constructivas. Este modelo es una etapa fundamental en la transición de una visión clásica del átomo (Bohr) a una descripción completamente cuántica integrada en la mecánica ondulatoria de Schrödinger.
El movimiento de los electrones en el átomo de De Broglie no corresponde a una trayectoria definida, sino a una distribución ondulatoria alrededor del núcleo. Los electrones se comportan como ondas circulares estacionarias. No siguen trayectorias clásicas, sino que ocupan regiones del espacio correspondientes a orbitales cuánticas.
En 1925, el modelo de Werner Heisenberg (1901-1976) introdujo una descripción probabilística del átomo, marcando una ruptura con los modelos clásicos.
El modelo del átomo propuesto por Heisenberg, conocido como mecánica matricial, es una de las primeras formulaciones de la mecánica cuántica. A diferencia del modelo de Bohr, que describe a los electrones moviéndose en órbitas circulares bien definidas, el modelo de Heisenberg introduce una descripción más abstracta y matemática de los estados y transiciones de los electrones.
Heisenberg transformó la imagen del átomo de una clásica a una concepción profundamente abstracta donde la realidad cuántica ya no es determinista, sino basada en probabilidades. El átomo es una entidad probabilística gobernada por leyes estadísticas donde sus propiedades medibles (energía, posición, velocidad, etc.) emergen solo cuando ocurre una interacción de observación (un acto de medición).
El átomo de Heisenberg se presenta como un núcleo denso compuesto únicamente de protones (identificados en 1919), rodeado de nubes difusas que representan la probabilidad de presencia de los electrones. Estas nubes pueden tomar diferentes formas, dependiendo de las orbitales.
Sin embargo, la estabilidad del átomo seguía siendo problemática sin una explicación clara para neutralizar las repulsiones electrostáticas.
Los movimientos de los electrones se describen de manera abstracta y matemática por vectores de estado y operadores matriciales. Los electrones no tienen trayectorias clásicas bien definidas, sino que existen en estados cuánticos superpuestos.
Las transiciones entre estos estados son cuantificadas y probabilísticas. El principio de incertidumbre de Heisenberg juega un papel fundamental en esta descripción, limitando la precisión con la que se puede conocer simultáneamente la posición y el momento de los electrones.
En 1926, la ecuación de Erwin Schrödinger (1887-1961) permitió describir los estados cuánticos de los electrones, marcando un avance mayor en la mecánica cuántica.
El modelo del átomo propuesto por Schrödinger, conocido como mecánica ondulatoria, es otra formulación fundamental de la mecánica cuántica. Schrödinger introdujo la ecuación que lleva su nombre para describir el comportamiento de las partículas cuánticas como los electrones en un átomo. Con su ecuación, Schrödinger puede calcular precisamente la vibración de esta onda y, por lo tanto, la luz que emite, recuperando el espectro correcto como en la teoría de Heisenberg.
En el modelo de Schrödinger, el estado de un electrón se describe mediante una función de onda (Ψ) que contiene toda la información posible sobre el estado cuántico del electrón.
La función de onda no es directamente observable, pero su cuadrado da la densidad de probabilidad de encontrar el electrón en una cierta posición en el espacio. Esto significa que el electrón no tiene una posición definida, sino una distribución de probabilidad de presencia.
Estas regiones de probabilidad se llaman orbitales atómicos. Fue Max Born (1882-1970) quien propuso la interpretación probabilística de la función de onda en 1926. Esta interpretación permitió entender los orbitales atómicos como regiones del espacio donde la probabilidad de encontrar un electrón es alta.
Los "movimientos" de los electrones se describen mediante funciones de onda que representan distribuciones de probabilidad de presencia en orbitales atómicos.
Los electrones no tienen trayectorias clásicas bien definidas, sino que existen en estados cuánticos superpuestos. Las transiciones entre niveles de energía se describen mediante cambios en la función de onda, y la evolución temporal de la función de onda es continua y determinista. Describe probabilidades en lugar de movimientos clásicos.
En 1926, la interpretación probabilística de Max Born permitió entender los orbitales atómicos como regiones de probabilidad.
Max Born interpretó la función de onda ψ (solución de la ecuación de Schrödinger) no como una onda material o física, sino como una amplitud de probabilidad. Más precisamente, propuso que la densidad de probabilidad de encontrar una partícula (como un electrón) en una posición dada es proporcional al valor absoluto al cuadrado de la función de onda.
El átomo según Max Born marca una ruptura completa con las concepciones clásicas: se convierte en una entidad donde las nociones de trayectoria, posición precisa y determinismo se abandonan en favor de una descripción estadística y probabilística basada en funciones de onda. Esta visión constituye una de las bases fundamentales de la naturaleza del átomo moderno.
En el átomo según Max Born, los electrones no siguen trayectorias clásicas como en los modelos de Rutherford o Bohr. Su posición exacta en un momento dado es fundamentalmente indeterminada. En lugar de trayectorias precisas, hablamos de nubes de probabilidad donde la densidad de la nube representa la probabilidad de presencia del electrón.
Born demuestra que los electrones no siguen trayectorias continuas y deterministas. Este comportamiento está directamente relacionado con el indeterminismo cuántico introducido por el principio de incertidumbre de Heisenberg.
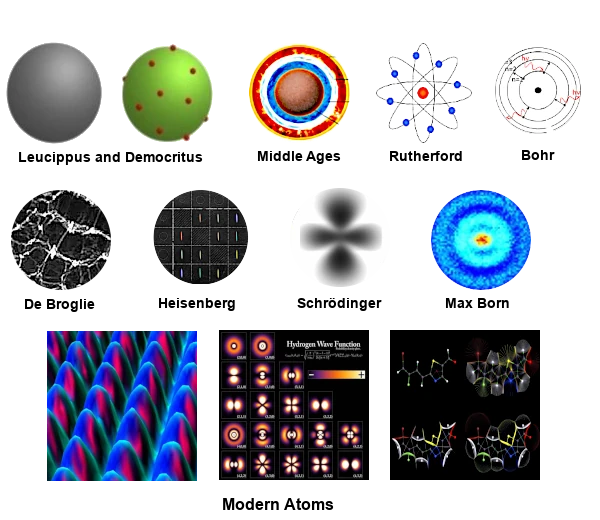
La visión moderna del átomo integra conceptos avanzados como el espín, las interacciones espín-órbita y los efectos relativistas.
La naturaleza del átomo moderno se describe mediante la mecánica cuántica, que ofrece una visión mucho más compleja y matizada que los modelos semiclásicos como los de Rutherford, Bohr, Heisenberg o Schrödinger.
La visión moderna incluye el espín del electrón y las interacciones espín-órbita, así como la teoría de campos cuánticos para describir las interacciones entre partículas y campos, incluyendo efectos relativistas y electromagnéticos. La QFT es esencial para entender fenómenos de alta energía e interacciones fundamentales.
Además, integra el principio de exclusión de Pauli, que estipula que dos electrones en el mismo átomo no pueden tener el mismo conjunto de números cuánticos. Esto explica la estructura en capas de los átomos y la periodicidad de los elementos en la tabla periódica.
En el átomo moderno, el concepto de "movimiento" de los electrones es efectivamente muy diferente del de los modelos clásicos. En lugar de hablar de trayectorias bien definidas, hablamos de distribuciones de probabilidad y estados cuánticos.
El átomo moderno no puede ser imaginado clásicamente debido a su naturaleza probabilística y no local. Sin embargo, representaciones simbólicas y esquemáticas pueden ayudar a visualizar ciertos aspectos del átomo moderno. Los orbitales atómicos, las nubes de probabilidad y los niveles de energía pueden proporcionar una imagen más completa del átomo moderno.
N.B.:
El término "no local" en el contexto de la mecánica cuántica y el átomo moderno se refiere a un fenómeno donde las propiedades de una partícula pueden ser influenciadas instantáneamente por eventos que ocurren a una distancia arbitraria, sin que haya una transmisión de información por un medio clásico.