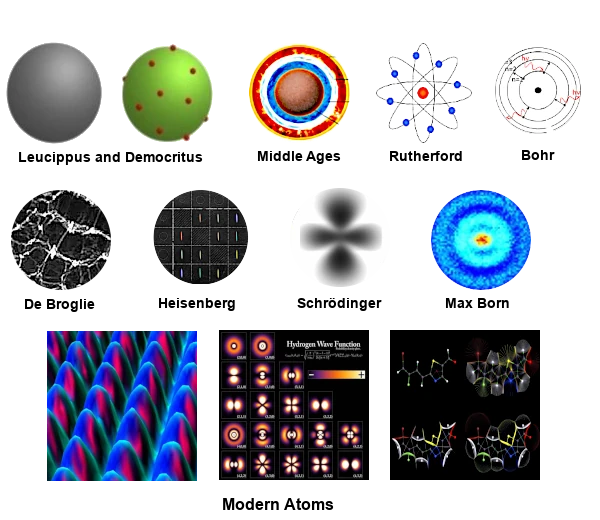
Dans l'antiquité, l'école atomiste est l'une des premières tentatives pour comprendre la nature de la matière à travers des corpuscules appelées 'atomos' (indivisible).
Deux philosophes grecs de l'école atomiste, Leucippe (500 - 440 BCE) et Démocrite (460 - 370 BCE) pensent que toute la matière est composée de corpuscules minuscules, en mouvement perpétuel, très solides et éternelles.
Leur conception des atomes était une abstraction philosophique fondée sur la logique : si l'on imagine couper continuellement un objet, peut-on le diviser à l'infini ?
Démocrite pensait que les atomes différaient en forme, taille, position et orientation. Par exemple, il imaginait que les atomes qui composent les liquides seraient lisses et ronds pour glisser facilement les uns sur les autres, tandis que ceux des solides seraient rugueux et crochus pour s'entrelacer.
Dans l’école atomiste de Leucippe et Démocrite, l’atome est en mouvement rectiligne perpétuel dans le vide, influencé par le clinamen. Le clinamen est une légère déviation aléatoire du mouvement des atomes qui permet l'émergence de la diversité dans le monde matériel.
Durant le Moyen Âge, les idées atomistes de Leucippe, Démocrite, et Épicure furent largement rejetées par les philosophes et théologiens. Cette période était dominée par la vision aristotélicienne de la matière.
Aristote (IVe siècle BCE) rejetait l'idée des atomes et du vide. Il proposait que toute matière était composée de quatre éléments fondamentaux : la terre, l'eau, l'air et le feu, associés à des qualités (chaud, froid, sec, humide). La matière était considérée comme continue, sans corpuscules indivisibles.
Au Moyen Âge, le mouvement des atomes n'existe pas vraiment dans le discours philosophique. Le mouvement était généralement vu comme une transformation des éléments en fonction des qualités internes ou des influences externes.
En 1911, l'expérience de Ernest Rutherford (1871-1937) a révolutionné notre compréhension de l'atome en démontrant l'existence d'un noyau central dense.
Rutherford a proposé un modèle de l’atome, aussi appelé modèle planétaire où un noyau central dense et massif, chargé positivement, contient la quasi-totalité de la masse de l’atome.
Des électrons légers gravitent autour du noyau, à une certaine distance, dans ce qui peut être comparé à une orbite, bien que leur mouvement exact ne soit pas encore bien défini.
N.B. :
Rutherford a mis au point son modèle grâce à une fine feuille d’or bombardée par des particules alpha (noyaux d’hélium). La majorité des particules passent sans déviation, montrant que l’atome est majoritairement vide. Quelques particules sont déviées fortement, et certaines rebondissent presque directement, prouvant la présence d’un noyau dense et positif.
Le modèle de Rutherford a une vision simplifiée du mouvement des électrons autour du noyau. Il est stable, circulaire et dicté par la force électrostatique d'attraction entre le noyau et les électrons. Ce modèle ne permet pas d'expliquer pourquoi les électrons ne perdent pas d'énergie et ne tombent pas dans le noyau (ce que la physique classique prédit).
En 1913, le modèle de Niels Bohr (1885-1962) a introduit la quantification des orbites électroniques, marquant une étape cruciale dans la compréhension de l'atome.
Niels Bohr représente une étape fondamentale dans l'histoire de la physique atomique, car il introduit une description quantifiée du mouvement des électrons dans un atome, en s'appuyant sur la mécanique classique et les premières idées de la mécanique quantique.
Ce qui distingue le modèle de Bohr des théories classiques est l'idée que seules certaines orbites sont autorisées. Ces orbites sont quantifiées, ce qui signifie que les électrons ne peuvent occuper que des niveaux d'énergie spécifiques. Les électrons émettent ou absorbent une quantité d'énergie bien définie, sous forme de quanta de lumière, lors de transitions entre orbites.
Le modèle de Bohr a réussi à expliquer avec succès des phénomènes comme la spectroscopie de l'hydrogène, en montrant que les raies spectrales sont dues à des transitions entre des niveaux d’énergie quantifiés. Malheureusement, ce modèle ne s'applique bien que pour l'hydrogène (un seul électron) et échoue pour les atomes plus complexes. Il n'explique pas les spectres d'atomes multi-électroniques.
Bohr suppose que les électrons se déplacent dans des orbites circulaires autour du noyau. Chaque orbite correspond à un niveau d'énergie spécifique. Pendant ce mouvement, il ne se passe rien, contrairement à la mécanique classique, où un électron en mouvement autour du noyau devrait perdre de l'énergie et s'effondrer sur le noyau.
Le modèle de Bohr postule que les électrons dans les orbites stables ne perdent pas d'énergie et restent dans ces orbites sans s'effondrer. Cependant, les électrons peuvent passer d'un niveau d'énergie à un autre en absorbant ou en émettant des quanta d'énergie (ce que nous appelons aujourd'hui un photon). Les sauts quantiques ne sont pas considérés comme des mouvements continus.
En 1924, la théorie de De Broglie (1892-1987) a introduit la dualité onde-particule, une notion fondamentale de la mécanique quantique.
L'idée centrale de la théorie de De Broglie est que si la lumière se comporte comme une onde et un corpscule, alors toute particule matérielle (comme les électrons) peut se comporter à la fois comme une onde et comme un corpscule, un concept appelé dualité onde-particule.
Les particules massives, telles que les électrons, possèdent une longueur d'onde associée appelée longueur d'onde de De Broglie. Le modèle de De Broglie donne une justification physique basée sur la dualité onde-particule.
De Broglie suggère que les électrons qui gravitent autour du noyau doivent être considérés non pas comme des particules ponctuelles suivant des trajectoires circulaires classiques, mais comme des ondes stationnaires et leurs positions probables sont distribuées de manière à correspondre à des interférences constructives. Ce modèle est une étape fondamentale dans le passage d'une vision classique de l'atome (Bohr) à une description pleinement quantique intégrée dans la mécanique ondulatoire de Schrödinger.
Le mouvement des électrons dans l'atome de De Broglie ne correspond pas à une trajectoire définie, mais plutôt à une distribution ondulatoire autour du noyau. Les électrons se comportent comme des ondes circulaires stationnaires. Ils ne suivent pas des trajectoires classiques mais occupent des régions de l'espace correspondant à des orbitales quantiques.
En 1925, le modèle de Werner Heisenberg (1901-1976) introduit une description probabiliste de l'atome, marquant une rupture avec les modèles classiques.
Le modèle de l'atome proposé par Heisenberg, connu sous le nom de mécanique matricielle, est l'une des premières formulations de la mécanique quantique. Contrairement au modèle de Bohr, qui décrit les électrons comme se déplaçant dans des orbites circulaires bien définies, le modèle de Heisenberg introduit une description plus abstraite et mathématique des états et des transitions des électrons.
Heisenberg a transformé l'image de l'atome passant d'une image classique à une conception profondément abstraite où la réalité quantique n’est plus déterministe, mais fondée sur des probabilités. L'atome est une entité probabiliste, gouvernée par des lois statistiques où ses propriétés mesurables (énergie, position, vitesse, etc.) émergent seulement lorsqu'une interaction d'observation a lieu (un acte de mesure).
L’atome d’Heisenberg se présente comme un noyau dense constitué uniquement de protons (identifiés en 1919), entouré de nuages diffus représentant la probabilité de présence des électrons. Ces nuages peuvent prendre différentes formes, selon les orbitales.
Cependant, la stabilité de l'atome restait problématique sans une explication claire pour neutraliser les répulsions électrostatiques.
Les mouvements des électrons sont décrits de manière abstraite et mathématique par des vecteurs d'état et des opérateurs matriciels. Les électrons n'ont pas de trajectoires classiques bien définies, mais existent dans des états quantiques superposés.
Les transitions entre ces états sont quantifiées et probabilistes. Le principe d'incertitude de Heisenberg joue un rôle fondamental dans cette description, limitant la précision avec laquelle la position et la quantité de mouvement des électrons peuvent être connues simultanément.
En 1926, l'équation de Erwin Schrödinger (1887-1961) a permis de décrire les états quantiques des électrons, marquant une avancée majeure dans la mécanique quantique.
Le modèle de l'atome proposé par Schrödinger, connu sous le nom de mécanique ondulatoire, est une autre formulation fondamentale de la mécanique quantique. Schrödinger a introduit l'équation qui porte son nom, pour décrire le comportement des particules quantiques comme les électrons dans un atome. Avec son équation Schrödinger peut calculer précisément la vibration de cette onde et donc la lumière qu'elle émet et retrouve le spectre correcte comme dans la théorie d'Heisenberg.
Dans le modèle de Schrödinger, l'état d'un électron est décrit par une fonction d'onde (Ψ) qui contient toutes les informations possibles sur l'état quantique de l'électron.
La fonction d'onde n'est pas directement observable, mais son carré donne la densité de probabilité de trouver l'électron à une certaine position dans l'espace. Cela signifie que l'électron n'a pas une position définie, mais plutôt une distribution de probabilité de présence.
Ces régions de probabilité sont appelées orbitales atomiques. C'est Max Born (1882-1970) qui a proposé l'interprétation probabiliste de la fonction d'onde en 1926. Cette interprétation a permis de comprendre les orbitales atomiques comme des régions de l'espace où la probabilité de trouver un électron est élevée.
Les "mouvements" des électrons sont décrits par des fonctions d'onde qui représentent des distributions de probabilité de présence dans des orbitales atomiques.
Les électrons n'ont pas de trajectoires classiques bien définies, mais existent dans des états quantiques superposés. Les transitions entre les niveaux d'énergie sont décrites par des changements dans la fonction d'onde, et l'évolution temporelle de la fonction d'onde est continue et déterministe. Elle décrit des probabilités plutôt que des mouvements classiques.
En 1926, l'interprétation probabiliste de Max Born a permis de comprendre les orbitales atomiques comme des régions de probabilité.
Max Born a interprété la fonction d'onde ψ (solution de l'équation de Schrödinger) non pas comme une onde matérielle ou physique, mais comme une amplitude de probabilité. Plus précisément, il a proposé que la densité de probabilité de présence d'une particule (comme un électron) à une position donnée est proportionnelle à la valeur absolue au carré de la fonction d'onde.
L’atome selon Max Born marque une rupture complète avec les conceptions classiques : il devient une entité où les notions de trajectoire, position précise et déterminisme sont abandonnées au profit d'une description statistique et probabiliste basée sur les fonctions d'onde. Cette vision constitue l'une des bases fondamentales de la nature de l'atome moderne.
Dans l'atome selon Max Born, les électrons ne suivent pas des trajectoires classiques comme dans les modèles de Rutherford ou de Bohr. Leur position exacte à un instant donné est fondamentalement indéterminée. Au lieu de trajectoires précises, on parle de nuages de probabilité où la densité du nuage représente la probabilité de présence de l’électron.
Born démontre que les électrons ne suivent pas de trajectoires continues et déterministes. Ce comportement est directement lié à l'indéterminisme quantique introduit par le principe d'incertitude d'Heisenberg.
La vision moderne de l'atome intègre des concepts avancés comme le spin, les interactions spin-orbite et les effets relativistes.
La nature de l'atome moderne est décrite par la mécanique quantique, qui offre une vision beaucoup plus complexe et nuancée que les modèles semi-classiques comme ceux de Rutherford, de Bohr, d'Heisenberg ou de Schrödinger.
La vision moderne inclut le spin de l'électron et les interactions spin-orbite, ainsi que la théorie des champs quantiques pour décrire les interactions entre les particules et les champs, y compris les effets relativistes et les interactions électromagnétiques. La QFT est essentielle pour comprendre les phénomènes à haute énergie et les interactions fondamentales.
De plus, elle intègre le principe d'exclusion de Pauli, qui stipule que deux électrons dans un même atome ne peuvent pas avoir le même ensemble de nombres quantiques. Cela explique la structure en couches des atomes et la périodicité des éléments dans le tableau périodique.
Dans l'atome moderne, le concept de "mouvement" des électrons est effectivement très différent de celui des modèles classiques. Plutôt que de parler de trajectoires bien définies, on parle de distributions de probabilité et d'états quantiques.
L'atome moderne ne peut pas être imagé de manière classique en raison de sa nature probabiliste et non-locale. Cependant, des représentations symboliques et schématiques peuvent aider à visualiser certains aspects de l'atome. Les orbitales atomiques, les nuages de probabilité, les niveaux d'énergie peuvent donner une image plus complète de l'atome moderne.
N.B. :
Le terme "non-locale" dans le contexte de la mécanique quantique et de l'atome moderne fait référence à un phénomène où les propriétés d'une particule peuvent être influencées instantanément par des événements se produisant à une distance arbitraire, sans qu'il y ait de transmission d'information par un moyen classique.