L'histoire commence à la fin du 18e siècle, lorsque le scientifique britannique William Nicholson (1753-1815) découvre que l'eau pouvait être décomposée en hydrogène et en oxygène par l'électricité. Mais c'est au début du 19e siècle que les bases de la pile à combustible moderne ont été posées.
En 1839, le physicien britannique William Grove (1811-1896) invente la première pile à combustible fonctionnelle, connue sous le nom de pile Grove. Elle utilisait de l'hydrogène comme combustible et de l'oxygène comme oxydant, et produisait de l'eau et de l'électricité comme produits de réaction.
Au cours des décennies suivantes, plusieurs chimistes ont apporté des contributions significatives à la technologie de la pile à combustible, Francis Thomas Bacon (1904-1992), Wilhelm Ostwald (1853-1932), Karl Kordesch (1922-2011).
En 1889, le chercheur allemand Ludwig Mond (1839-1909) développe une pile à combustible à base de gaz, utilisant du monoxyde de carbone comme combustible.
En 1965, la mission spatiale Gemini 5 a été la première à utiliser une pile à combustible à membrane d'échange protonique (PEMFC) à bord de son vaisseau spatial.
Depuis, différents types de piles à combustible ont été développés, notamment les piles alcalines, PEMFC, à oxyde solide et à carbonate fondu, chacune présentant des avantages dans divers domaines, tels que l'espace, les véhicules électriques, les systèmes de secours d'urgence et les applications stationnaires.
L'utilisation du terme "pile à combustible" met l'accent sur le processus électrochimique qui se produit à l'intérieur du dispositif, plutôt que sur le type spécifique de carburant utilisé. La pile à combustible fournit de l'électricité de manière continue tant qu'elle est alimentée en temps réel, en combustible et en oxydant. Contrairement aux batteries, la pile à combustible ne stocke pas l'énergie électrique et n'a donc pas besoin d'être rechargée. Par contre, il est nécessaire de stocker et de transporter le combustible de manière appropriée pour une utilisation continue.
Le terme "combustible" est utilisé de manière générale pour englober différents types de carburants qui peuvent être utilisés, tels que l'hydrogène (H2), le méthanol (CH3OH), le méthane (CH4), le propane (C3H8), le gaz de synthèse, un mélange de monoxyde de carbone (CO) et d'hydrogène (H2), etc. La terminologie générale de "pile à combustible" permet d'inclure d'autres composés chimiques à l'avenir.
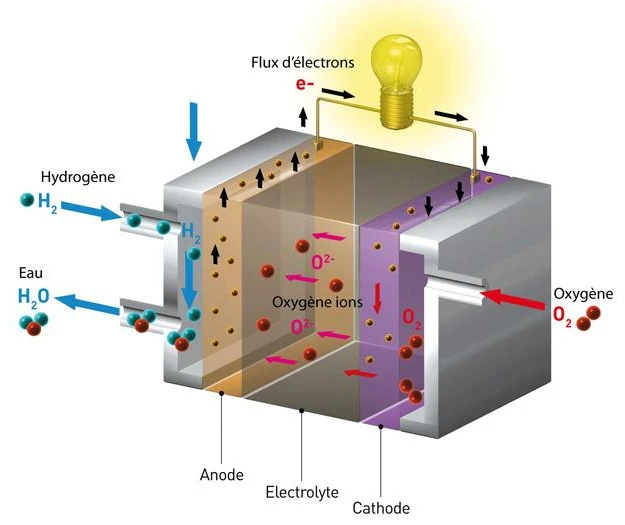
La pile à combustible à hydrogène-oxygène, également connue sous le nom de pile à combustible à membrane d'échange de protons (PEMFC), nécessite une alimentation continue en hydrogène et en oxygène.
L'hydrogène est fourni à l'anode (électrode négative), tandis que l'oxygène (souvent de l'air) est fourni à la cathode (électrode positive).
Les deux électrodes sont séparées par une membrane polymère conductrice d'ions, appelée électrolyte.
À l'anode, l'hydrogène se décompose en ions d'hydrogène (protons H+) et en électrons (e-) grâce à une réaction de dissociation, catalysée par un matériau tel que le platine. Le catalyseur à l'anode, facilite cette réaction (2H2 → 4H+ + 4e-).
Les protons sont ensuite transportés à travers la membrane d'échange de protons (PEM) vers la cathode, tandis que les électrons sont forcés de circuler à travers un circuit externe, créant un courant électrique qui peut être utilisé pour alimenter des dispositifs électriques.
Ainsi, les électrons fournissent de l'électricité, puis rejoignent la cathode où ils participent à la réaction de réduction avec les protons et l'oxygène pour former de l'eau.
Le catalyseur à la cathode, généralement du platine allié à d'autres métaux, facilite cette réaction (O2 + 4H+ + 4e- → 2H2O).
L'eau produite à la cathode, ainsi que l'excès d'hydrogène et d'oxygène non consommés, sont évacués de la pile à combustible sous forme de vapeur d'eau et d'air. L'équation générale de la réaction chimique dans une pile à combustible à hydrogène-oxygène est 2H2 (hydrogène) + O2 (oxygène) → 2H2O (eau).
L'hydrogène est l'élément le plus abondant dans l'univers, mais il n'est pas disponible sous forme d'hydrogène libre sur Terre. Cependant, il peut être produit à partir de diverses sources (électrolyse de l'eau, reformage d'hydrocarbures, etc).
Les piles à combustible à hydrogène-oxygène, ont un rendement énergétique élevé, ce qui signifie qu'elles peuvent convertir en électricité, une grande partie de l'énergie chimique contenue dans les liaisons hydrogène.
Ces piles à combustible peuvent convertir entre 40 % et 60 % de l'énergie chimique de l'hydrogène en électricité utilisable. Le reste de l'énergie est dissipé sous forme de chaleur. A titre de comparaison, le rendement des moteurs à combustion interne traditionnels se situe entre 25 % et 40 %.
Dans l'eau, l'énergie de liaison est relativement élevée par rapport à d'autres énergies de liaison moléculaire. L'interaction entre les atomes d'hydrogène et l'atome d'oxygène forme une liaison covalente polarisée. Cette polarité renforce l'interaction entre les atomes, augmentant ainsi l'énergie de liaison. Dans la molécule d'eau, l'oxygène est plus électronégatif que l'hydrogène, ce qui signifie qu'il attire plus fortement les électrons partagés dans la liaison, créant ainsi une charge partielle négative sur l'oxygène et une charge partielle positive sur les hydrogènes. L'énergie de liaison covalente moyenne entre l'atome d'hydrogène et l'atome d'oxygène est d'environ 460 kilojoules par mole (kJ/mol). Une partie de cette énergie est convertie en énergie électrique à travers le processus de réaction électrochimique dans la pile à combustible.
Ainsi, l'hydrogène est considéré comme le combustible idéal pour les piles à combustible en raison de son potentiel élevé en termes d'efficacité énergétique et de réduction des émissions.