A história começa no final do século 18, quando o cientista britânico William Nicholson (1753-1815) descobriu que a água podia ser decomposta em hidrogênio e oxigênio pela eletricidade. Mas foi no início do século 19 que foram lançadas as bases da moderna célula de combustível.
Em 1839, o físico britânico William Grove (1811-1896) inventou a primeira célula de combustível funcional, conhecida como célula de Grove. Ele usava hidrogênio como combustível e oxigênio como oxidante e produzia água e eletricidade como produtos de reação.
Nas décadas seguintes, vários químicos fizeram contribuições significativas para a tecnologia de células de combustível, Francis Thomas Bacon (1904-1992), Wilhelm Ostwald (1853-1932), Karl Kordesch (1922-2011).
Em 1889, o pesquisador alemão Ludwig Mond (1839-1909) desenvolveu uma célula de combustível à base de gás, usando monóxido de carbono como combustível.
Em 1965, a missão espacial Gemini 5 foi a primeira a usar uma célula de combustível de membrana de troca de prótons (PEMFC) a bordo de sua espaçonave.
Desde então, diferentes tipos de células de combustível foram desenvolvidos, incluindo células de combustível alcalinas, PEMFC, óxido sólido e carbonato fundido, cada uma com vantagens em vários campos, como espaço, veículos elétricos, sistemas de backup, etc. aplicações estacionárias.
O uso do termo "célula de combustível" enfatiza o processo eletroquímico que ocorre dentro do dispositivo, e não o tipo específico de combustível usado. A célula de combustível fornece eletricidade continuamente, desde que seja fornecida em tempo real com combustível e oxidante. Ao contrário das baterias, a célula de combustível não armazena energia elétrica e, portanto, não precisa ser recarregada. Por outro lado, é necessário armazenar e transportar o combustível adequadamente para uso contínuo.
O termo "combustível" é usado amplamente para abranger diferentes tipos de combustíveis que podem ser usados, como hidrogênio (H2), metanol (CH3OH), metano (CH4), propano (C3H8), gás sintético, uma mistura de monóxido de carbono ( CO) e hidrogênio (H2), etc. A terminologia geral de "célula de combustível" permite que outros compostos químicos sejam incluídos no futuro.
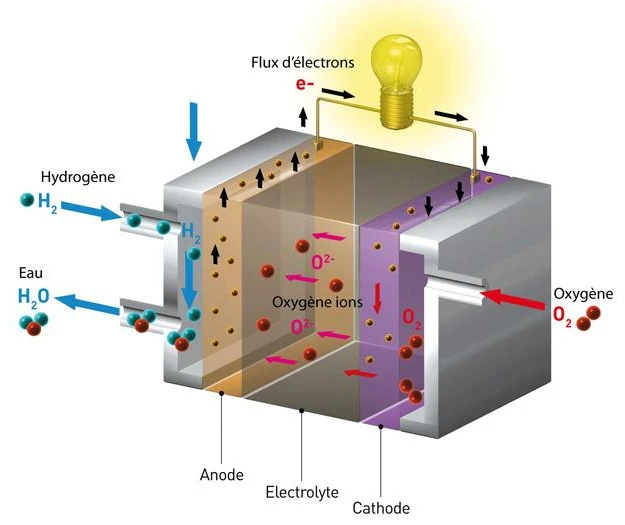
A célula de combustível de hidrogênio-oxigênio, também conhecida como célula de combustível de membrana de troca de prótons (PEMFC), requer um suprimento contínuo de hidrogênio e oxigênio.
O hidrogênio é fornecido ao ânodo (eletrodo negativo), enquanto o oxigênio (geralmente ar) é fornecido ao cátodo (eletrodo positivo).
Os dois eletrodos são separados por uma membrana de polímero condutora de íons, chamada de eletrólito.
No ânodo, o hidrogênio se decompõe em íons de hidrogênio (prótons H+) e elétrons (e-) por meio de uma reação de dissociação, catalisada por um material como a platina. O catalisador no ânodo facilita esta reação (2H2 → 4H+ + 4e-).
Os prótons são então transportados através da membrana de troca de prótons (PEM) para o cátodo, enquanto os elétrons são forçados a fluir por um circuito externo, criando uma corrente elétrica que pode ser usada para alimentar dispositivos elétricos.
Assim, os elétrons fornecem eletricidade, depois se juntam ao cátodo onde participam da reação de redução com os prótons e o oxigênio para formar água.
O catalisador no cátodo, geralmente platina ligada a outros metais, facilita essa reação (O2 + 4H+ + 4e- → 2H2O).
A água produzida no cátodo, bem como o excesso de hidrogênio e oxigênio não consumido, são evacuados da célula de combustível na forma de vapor de água e ar. A equação geral para a reação química em uma célula de combustível de hidrogênio-oxigênio é 2H2 (hidrogênio) + O2 (oxigênio) → 2H2O (água).
O hidrogênio é o elemento mais abundante no universo, mas não está disponível como hidrogênio livre na Terra. No entanto, pode ser produzido a partir de várias fontes (eletrólise da água, reforma de hidrocarbonetos, etc).
As células de combustível de hidrogênio-oxigênio têm alta eficiência energética, o que significa que elas podem converter grande parte da energia química contida nas ligações de hidrogênio em eletricidade.
Essas células de combustível podem converter entre 40% e 60% da energia química do hidrogênio em eletricidade utilizável. O resto da energia é dissipada como calor. Para comparação, a eficiência dos motores de combustão interna tradicionais está entre 25% e 40%.
Na água, a energia de ligação é relativamente alta em comparação com outras energias de ligação molecular. A interação entre os átomos de hidrogênio e o átomo de oxigênio forma uma ligação covalente polarizada. Essa polaridade fortalece a interação entre os átomos, aumentando assim a energia de ligação. Na molécula de água, o oxigênio é mais eletronegativo que o hidrogênio, o que significa que ele atrai os elétrons compartilhados mais fortemente para a ligação, criando assim uma carga parcial negativa no oxigênio e uma carga parcial positiva nos hidrogênios. A energia de ligação covalente média entre o átomo de hidrogênio e o átomo de oxigênio é de cerca de 460 quilojoules por mol (kJ/mol). Parte dessa energia é convertida em energia elétrica por meio do processo de reação eletroquímica na célula a combustível.
Assim, o hidrogênio é considerado o combustível ideal para células a combustível devido ao seu alto potencial de eficiência energética e redução de emissões.