É ao examinar os constituintes mais pequenos da matéria que os cientistas (século XX) explicarão o funcionamento de todo o universo.
Um átomo é composto por um núcleo ao redor do qual se movem um ou mais elétrons. O que caracteriza o núcleo é seu número de prótons (Z), que varia de 1 a 110, e determina o elemento, por exemplo, o ferro (Fe26) tem 26 prótons, 26 é seu número atômico (Z). O número de nêutrons (N), que varia de 0 a 160, caracteriza os isótopos do elemento, por exemplo, o hidrogênio (H1) tem um próton e nenhum nêutron, o deutério (H2) tem um próton e um nêutron, o trítio (H3) tem um próton e dois nêutrons.
Essas três formas de hidrogênio têm apenas um elétron, pois há apenas uma carga elétrica, o único próton.
Atenção, apenas no caso do hidrogênio os isótopos do elemento recebem nomes diferentes; em todos os outros casos, indica-se apenas o número de nucleons, o que permite encontrar o número de nêutrons. Por exemplo, o ferro (Fe26) tem vários isótopos, incluindo Fe56, que tem 30 nêutrons, Fe57 tem 31 nêutrons, Fe58 tem 32 nêutrons, o número de nêutrons diferencia os isótopos.
No átomo, são os elétrons que dão consistência à matéria, embora sejam muito leves (≈10-27 g). O próton é ≈2000 vezes mais pesado e concentra a maior parte da massa do átomo (99,99%). Para os átomos estáveis, a massa varia entre 1.674×10-24 g para o Hidrogênio e 3.953×10-22 g para o Urânio.
Desde 1811, conhecemos o tamanho aproximado de um átomo; Amedeo Avogadro (1776-1856) estimou o tamanho dos átomos em 10-10 metros (Angstrom), ou seja, um pouco mais de uma centésima de milímetro. Em 1911, Ernest Rutherford (1871-1937) descobriu o núcleo atômico.
Rutherford especificou a estrutura do átomo ao bombardear uma folha de ouro com partículas da desintegração radioativa do urânio. Ele deu um tamanho ao núcleo atômico da ordem de 10-14 metros.
Rutherford representou cada átomo como um mini sistema solar, com o núcleo no centro e os elétrons orbitando como planetas.
Desde a chegada da mecânica quântica (década de 1920), a imagem do núcleo é perturbadora; o núcleo já não é um sistema composto de corpúsculos associados. O núcleo, regido pela mecânica quântica, não é observável porque, para observar os nucleons dentro do núcleo, seria necessário iluminar as partículas com uma luz tão intensa que o núcleo se desintegraria instantaneamente.
O mesmo ocorre com o elétron; não representamos mais o elétron como um corpúsculo que gira em uma órbita bem definida ao redor do núcleo. O elétron não é nem uma onda nem um corpúsculo; no entanto, falamos da dualidade onda-partícula, que é o fundamento da mecânica quântica. O elétron não segue uma trajetória única; provavelmente está localizado em uma região ao redor do núcleo chamada orbital atômica.
Desde 1924, toda a matéria está dotada de uma onda associada, segundo a hipótese de Louis De Broglie (1892-1987). Com essa hipótese, ele generalizou a "dualidade onda-partícula" introduzida para a luz por Max Planck (1858-1947) no início do século XX para todas as partículas da matéria.
Todas as partículas subatômicas, portanto, têm um comprimento de onda. O comprimento de onda λ de uma partícula subatômica e sua quantidade de movimento p estão relacionados pela equação: λ=h/p, onde h é a constante de Planck, p é a quantidade de movimento, ou seja, o produto da massa pelo vetor velocidade (p=mv). O elétron leva cerca de 150 atossegundos (1.5×10−16 segundos) para "orbitar" o átomo de hidrogênio.
Graças à fórmula de Einstein (E=mc2), toda a matéria está dotada de uma energia associada. Em outras palavras, quanto menor o comprimento de onda, maior a energia (E=h/λ). Essa energia modificará a forma dos átomos. Os fundamentos da mecânica quântica são, portanto, estabelecidos.
A matéria é composta de partículas muito pequenas (elétrons, neutrinos, quarks) que têm massa, carga, energia, dimensão, onda e spin.
Em 2013, ainda não podemos ver as partículas do núcleo atômico, mas apenas a camada externa do átomo, ou seja, sua nuvem eletrônica. A nuvem eletrônica ocupa toda a extensão espacial do átomo, pois é cerca de 10.000 vezes maior que seu núcleo.
Na mecânica quântica ondulatória, uma partícula é representada por uma função de onda (vetor de estado), mas é muito difícil conceituar o conceito fundamental da mecânica quântica ou o estado quântico de um sistema.
Em 1927, Max Born (1882-1970) deu uma interpretação da função de onda onde o quadrado da função de onda representa a probabilidade de encontrar a partícula em um local preciso quando uma medição é feita.
Uma função de onda é, portanto, uma amplitude de probabilidade ou uma densidade de probabilidade da presença do sistema em uma posição dada em um momento dado. Essa função tem um valor complexo. Se um número real ou um valor real representa, por exemplo, o comprimento de um segmento em uma linha, um valor complexo é representado por um vetor em um plano. Este vetor não tem apenas um comprimento no espaço, mas também uma fase que corresponde à direção do vetor.
Se não representamos mais o elétron como uma partícula pontual em uma órbita regular ao redor de um núcleo, como podemos visualizá-lo?
O elétron não segue uma trajetória única ao redor do núcleo; ele está localizado em algum lugar de uma "vasta região" chamada nuvem eletrônica ou orbital atômica. O estado de um elétron é, portanto, representado por este volume de espaço ao redor do núcleo no qual ele está deslocalizado. O estado fundamental de um átomo de hidrogênio mede aproximadamente 1 angstrom, ou seja, 10-10 metros.
Para visualizar o elétron nessa região, basta imaginar um grão de arroz de cerca de 5 mm se movendo em uma esfera de cerca de 50 metros de diâmetro. Mas nem sempre é uma esfera; a forma dessa região do espaço atômico depende da energia do elétron e de seu momento angular.
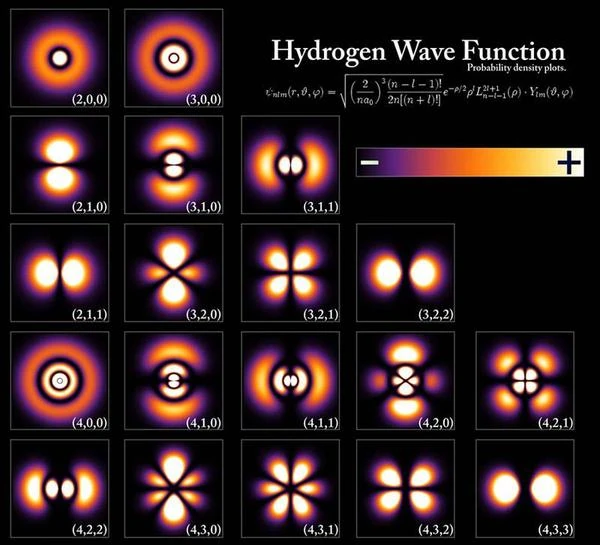
As orbitais do elétron podem assumir diferentes formas características dependendo da natureza do átomo, por exemplo, a orbital do átomo de hidrogênio na primeira linha no topo da imagem tem uma forma esférica, a orbital na segunda linha tem a forma de duas gotas de água, a orbital na terceira linha tem a forma de quatro gotas de água. Em resumo, a orbital corresponde à região do espaço onde o elétron está deslocalizado; o estado do elétron está em uma superposição de todas as posições possíveis dentro da orbital atômica, cuja forma varia. A forma da orbital muda quando o átomo é excitado, como na primeira linha. Se o átomo for excitado ainda mais, a forma da orbital muda novamente, como na segunda linha ou segunda camada eletrônica. Em um estado muito excitado chamado "estado de Rydberg," os elétrons estão deslocalizados em um toro de "raio muito grande" que pode medir até 1000 angstroms; o número quântico principal n (número da camada) é muito alto, entre 50 e 100.