Os átomos são estáveis quando o número de nêutrons no núcleo é aproximadamente igual ao número de prótons. Quando essa diferença é muito grande, o átomo se torna instável.
Núcleos pesados de isótopos ricos em nêutrons com número atômico maior do que o do ferro (N = 26) são formados em temperaturas muito altas (>109 K) durante a explosão de estrelas massivas (supernovas).
No entanto, todos os núcleos buscam uma estabilidade energética mais econômica. Assim, para retornar a um estado estável, eles devem se transmutar, expulsando energia na forma de massa ou radiação. Isso leva à desintegração espontânea do núcleo, conhecida como radioatividade.
A radioatividade é, portanto, um fenômeno natural aleatório que ocorre no núcleo, nas profundezas do átomo, e resulta em um novo núcleo mais estável.
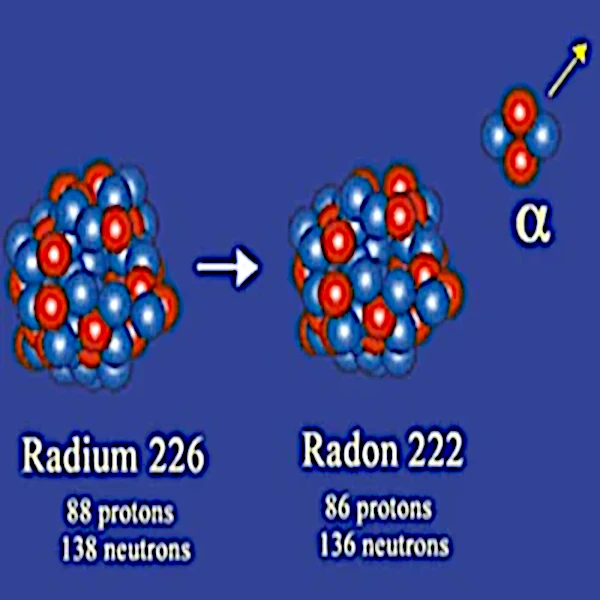
Em 1908, Ernest Rutherford (1871-1937) identificou as partículas alfa como núcleos de hélio-4 compostos por 2 prótons e 2 nêutrons. Assim, o núcleo estável resultante da desintegração radioativa tem dois nêutrons e dois prótons a menos do que o núcleo instável do qual se originou.
A emissão de uma partícula alfa afeta principalmente núcleos muito grandes, como o do rádio-226 (88 prótons e 138 nêutrons), do tório-232 (90 prótons e 142 nêutrons), do urânio-238 (92 prótons e 136 nêutrons), etc.
Esses núcleos são instáveis porque a repulsão coulombiana entre prótons, que aumenta como o quadrado do número de prótons, é mais forte do que a atração nuclear entre nucleons. Nesse ponto, o núcleo expulsa um pacote de quatro nucleons.
Para a matéria, esta é a maneira mais rápida e econômica de recuperar a estabilidade.
O rádio não possui isótopos estáveis. O isótopo predominante do rádio, descoberto por Pierre e Marie Curie em 21 de dezembro de 1898 ao extraí-lo da pechblenda (minério de urânio), é o rádio-226, cuja meia-vida radioativa ou período de semidesintegração é de 1.600 anos (tempo necessário para que metade dos núcleos inicialmente presentes se transformem em outros núcleos).
O rádio possui propriedades naturais surpreendentes (radioluminescência, produção espontânea de calor, fonte radioativa, etc.). Além disso, torna a atmosfera condutora de eletricidade e descarrega capacitores à distância, o que levou ao desenvolvimento do contador Geiger-Müller. O contador Geiger, desenvolvido em 1928, é utilizado para medir uma ampla gama de radiações ionizantes (radiação alfa, beta, gama e raios X).
O rádio foi utilizado até 1950 por suas propriedades de radioluminescência, especialmente em tintas destinadas à relojoaria. A partir da década de 1920, doenças ocupacionais foram identificadas entre as trabalhadoras que afinavam seus pincéis de tinta enriquecida com rádio, levando-os à boca. Essas doenças levaram a uma primeira investigação epidemiológica e ao fechamento progressivo das fábricas.
Devido à sua grande massa e carga, as partículas alfa têm baixa penetração. Geralmente, podem ser interrompidas pela pele. No entanto, se ingeridas, tornam-se perigosas. Doses suficientemente altas podem causar câncer.
Nota: A ionização é o processo de remover ou adicionar cargas eletromagnéticas a um átomo.