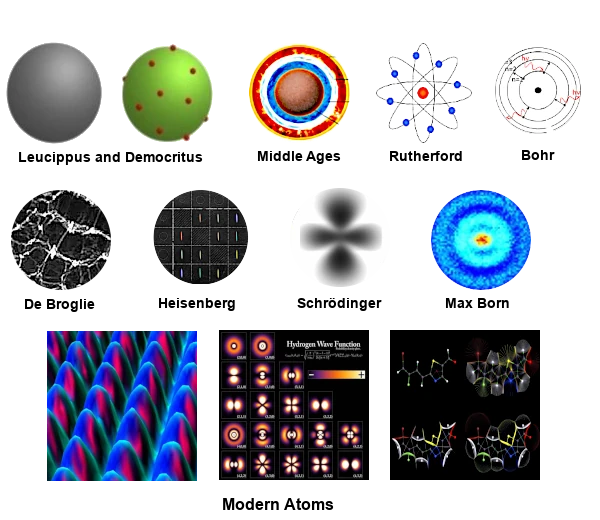
Descrição da imagem: Os Modelos Atômicos Através dos Tempos: De Demócrito a Schrödinger. Fonte da imagem: astronoo.com
Na antiguidade, a escola atomista foi uma das primeiras tentativas de compreender a natureza da matéria através de corpúsculos chamados 'atomos' (indivisíveis).
Dois filósofos gregos da escola atomista, Leucipo (500 - 440 a.C.) e Demócrito (460 - 370 a.C.) pensavam que toda a matéria era composta de corpúsculos minúsculos, em movimento perpétuo, muito sólidos e eternos.
Sua concepção dos átomos era uma abstração filosófica baseada na lógica: se imaginarmos cortar continuamente um objeto, podemos dividi-lo infinitamente?
Demócrito pensava que os átomos diferiam em forma, tamanho, posição e orientação. Por exemplo, ele imaginava que os átomos que compõem os líquidos seriam lisos e redondos para deslizar facilmente uns sobre os outros, enquanto os dos sólidos seriam rugosos e com ganchos para se entrelaçar.
Na escola atomista de Leucipo e Demócrito, o átomo está em movimento retilíneo perpétuo no vácuo, influenciado pelo clinamen. O clinamen é uma ligeira desviação aleatória do movimento dos átomos que permite a emergência da diversidade no mundo material.
Durante a Idade Média, as ideias atomistas de Leucipo, Demócrito e Epicuro foram amplamente rejeitadas por filósofos e teólogos. Este período foi dominado pela visão aristotélica da matéria.
Aristóteles (século IV a.C.) rejeitava a ideia dos átomos e do vácuo. Ele propunha que toda a matéria era composta de quatro elementos fundamentais: terra, água, ar e fogo, associados a qualidades (quente, frio, seco, úmido). A matéria era considerada contínua, sem corpúsculos indivisíveis.
Na Idade Média, o movimento dos átomos não existia realmente no discurso filosófico. O movimento era geralmente visto como uma transformação dos elementos de acordo com qualidades internas ou influências externas.
Em 1911, o experimento de Ernest Rutherford (1871-1937) revolucionou nossa compreensão do átomo ao demonstrar a existência de um núcleo central denso.
Rutherford propôs um modelo do átomo, também conhecido como modelo planetário, onde um núcleo central denso e maciço, carregado positivamente, contém quase toda a massa do átomo.
Elétrons leves orbitam ao redor do núcleo a uma certa distância, em algo que pode ser comparado a uma órbita, embora seu movimento exato ainda não esteja bem definido.
N.B.:
Rutherford desenvolveu seu modelo usando uma fina folha de ouro bombardeada por partículas alfa (núcleos de hélio). A maioria das partículas passa sem desvio, mostrando que o átomo é majoritariamente vazio. Algumas partículas são fortemente desviadas e algumas quase ricocheteiam diretamente, provando a presença de um núcleo denso e positivo.
O modelo de Rutherford tem uma visão simplificada do movimento dos elétrons ao redor do núcleo. É estável, circular e ditado pela força eletrostática de atração entre o núcleo e os elétrons. Este modelo não explica por que os elétrons não perdem energia e caem no núcleo (o que a física clássica prevê).
Em 1913, o modelo de Niels Bohr (1885-1962) introduziu a quantização das órbitas eletrônicas, marcando um passo crucial na compreensão do átomo.
Niels Bohr representa uma etapa fundamental na história da física atômica, pois introduziu uma descrição quantificada do movimento dos elétrons em um átomo, baseando-se na mecânica clássica e nas primeiras ideias da mecânica quântica.
O que distingue o modelo de Bohr das teorias clássicas é a ideia de que apenas certas órbitas são permitidas. Essas órbitas são quantificadas, o que significa que os elétrons só podem ocupar níveis de energia específicos. Os elétrons emitem ou absorvem uma quantidade bem definida de energia, na forma de quanta de luz, durante as transições entre órbitas.
O modelo de Bohr explicou com sucesso fenômenos como a espectroscopia do hidrogênio, mostrando que as linhas espectrais são devidas a transições entre níveis de energia quantificados. Infelizmente, este modelo só funciona bem para o hidrogênio (um único elétron) e falha para átomos mais complexos. Não explica os espectros de átomos multi-eletrônicos.
Bohr supõe que os elétrons se movem em órbitas circulares ao redor do núcleo. Cada órbita corresponde a um nível de energia específico. Durante este movimento, nada acontece, ao contrário da mecânica clássica, onde um elétron em movimento ao redor do núcleo deveria perder energia e colapsar no núcleo.
O modelo de Bohr postula que os elétrons em órbitas estáveis não perdem energia e permanecem nessas órbitas sem colapsar. No entanto, os elétrons podem passar de um nível de energia para outro absorvendo ou emitindo quanta de energia (o que chamamos hoje de fóton). Os saltos quânticos não são considerados movimentos contínuos.
Em 1924, a teoria de De Broglie (1892-1987) introduziu a dualidade onda-partícula, uma noção fundamental da mecânica quântica.
A ideia central da teoria de De Broglie é que, se a luz se comporta como uma onda e um corpúsculo, então qualquer partícula material (como os elétrons) pode se comportar tanto como uma onda quanto um corpúsculo, um conceito conhecido como dualidade onda-partícula.
As partículas massivas, como os elétrons, possuem um comprimento de onda associado chamado comprimento de onda de De Broglie. O modelo de De Broglie fornece uma justificativa física baseada na dualidade onda-partícula.
De Broglie sugere que os elétrons que orbitam o núcleo devem ser considerados não como partículas pontuais seguindo trajetórias circulares clássicas, mas como ondas estacionárias, e suas posições prováveis estão distribuídas de maneira a corresponder a interferências construtivas. Este modelo é uma etapa fundamental na transição de uma visão clássica do átomo (Bohr) para uma descrição completamente quântica integrada na mecânica ondulatória de Schrödinger.
O movimento dos elétrons no átomo de De Broglie não corresponde a uma trajetória definida, mas a uma distribuição ondulatória ao redor do núcleo. Os elétrons se comportam como ondas circulares estacionárias. Eles não seguem trajetórias clássicas, mas ocupam regiões do espaço correspondentes a orbitais quânticas.
Em 1925, o modelo de Werner Heisenberg (1901-1976) introduziu uma descrição probabilística do átomo, marcando uma ruptura com os modelos clássicos.
O modelo do átomo proposto por Heisenberg, conhecido como mecânica matricial, é uma das primeiras formulações da mecânica quântica. Ao contrário do modelo de Bohr, que descreve os elétrons se movendo em órbitas circulares bem definidas, o modelo de Heisenberg introduz uma descrição mais abstrata e matemática dos estados e transições dos elétrons.
Heisenberg transformou a imagem do átomo de uma clássica para uma concepção profundamente abstrata onde a realidade quântica não é mais determinista, mas baseada em probabilidades. O átomo é uma entidade probabilística governada por leis estatísticas onde suas propriedades mensuráveis (energia, posição, velocidade, etc.) emergem apenas quando ocorre uma interação de observação (um ato de medição).
O átomo de Heisenberg se apresenta como um núcleo denso composto apenas de prótons (identificados em 1919), rodeado de nuvens difusas que representam a probabilidade de presença dos elétrons. Essas nuvens podem assumir diferentes formas, dependendo das orbitais.
No entanto, a estabilidade do átomo permanecia problemática sem uma explicação clara para neutralizar as repulsões eletrostáticas.
Os movimentos dos elétrons são descritos de maneira abstrata e matemática por vetores de estado e operadores matriciais. Os elétrons não têm trajetórias clássicas bem definidas, mas existem em estados quânticos superpostos.
As transições entre esses estados são quantificadas e probabilísticas. O princípio da incerteza de Heisenberg desempenha um papel fundamental nesta descrição, limitando a precisão com que a posição e o momento dos elétrons podem ser conhecidos simultaneamente.
Em 1926, a equação de Erwin Schrödinger (1887-1961) permitiu descrever os estados quânticos dos elétrons, marcando um avanço significativo na mecânica quântica.
O modelo do átomo proposto por Schrödinger, conhecido como mecânica ondulatória, é outra formulação fundamental da mecânica quântica. Schrödinger introduziu a equação que leva seu nome para descrever o comportamento das partículas quânticas, como os elétrons em um átomo. Com sua equação, Schrödinger pode calcular precisamente a vibração dessa onda e, portanto, a luz que ela emite, recuperando o espectro correto como na teoria de Heisenberg.
No modelo de Schrödinger, o estado de um elétron é descrito por uma função de onda (Ψ) que contém toda a informação possível sobre o estado quântico do elétron.
A função de onda não é diretamente observável, mas seu quadrado dá a densidade de probabilidade de encontrar o elétron em uma certa posição no espaço. Isso significa que o elétron não tem uma posição definida, mas uma distribuição de probabilidade de presença.
Essas regiões de probabilidade são chamadas orbitais atômicos. Foi Max Born (1882-1970) quem propôs a interpretação probabilística da função de onda em 1926. Esta interpretação permitiu entender os orbitais atômicos como regiões do espaço onde a probabilidade de encontrar um elétron é alta.
Os "movimentos" dos elétrons são descritos por funções de onda que representam distribuições de probabilidade de presença em orbitais atômicos.
Os elétrons não têm trajetórias clássicas bem definidas, mas existem em estados quânticos superpostos. As transições entre níveis de energia são descritas por mudanças na função de onda, e a evolução temporal da função de onda é contínua e determinista. Ela descreve probabilidades em vez de movimentos clássicos.
Em 1926, a interpretação probabilística de Max Born permitiu entender os orbitais atômicos como regiões de probabilidade.
Max Born interpretou a função de onda ψ (solução da equação de Schrödinger) não como uma onda material ou física, mas como uma amplitude de probabilidade. Mais precisamente, ele propôs que a densidade de probabilidade de encontrar uma partícula (como um elétron) em uma posição dada é proporcional ao valor absoluto ao quadrado da função de onda.
O átomo segundo Max Born marca uma ruptura completa com as concepções clássicas: ele se torna uma entidade onde as noções de trajetória, posição precisa e determinismo são abandonadas em favor de uma descrição estatística e probabilística baseada em funções de onda. Esta visão constitui uma das bases fundamentais da natureza do átomo moderno.
No átomo segundo Max Born, os elétrons não seguem trajetórias clássicas como nos modelos de Rutherford ou Bohr. Sua posição exata em um dado momento é fundamentalmente indeterminada. Em vez de trajetórias precisas, falamos de nuvens de probabilidade onde a densidade da nuvem representa a probabilidade de presença do elétron.
Born demonstra que os elétrons não seguem trajetórias contínuas e deterministas. Este comportamento está diretamente relacionado ao indeterminismo quântico introduzido pelo princípio da incerteza de Heisenberg.
A visão moderna do átomo integra conceitos avançados como o spin, as interações spin-órbita e os efeitos relativistas.
A natureza do átomo moderno é descrita pela mecânica quântica, que oferece uma visão muito mais complexa e matizada do que os modelos semiclássicos como os de Rutherford, Bohr, Heisenberg ou Schrödinger.
A visão moderna inclui o spin do elétron e as interações spin-órbita, bem como a teoria dos campos quânticos para descrever as interações entre partículas e campos, incluindo efeitos relativistas e interações eletromagnéticas. A QFT é essencial para entender fenômenos de alta energia e interações fundamentais.
Além disso, integra o princípio de exclusão de Pauli, que estipula que dois elétrons no mesmo átomo não podem ter o mesmo conjunto de números quânticos. Isso explica a estrutura em camadas dos átomos e a periodicidade dos elementos na tabela periódica.
No átomo moderno, o conceito de "movimento" dos elétrons é efetivamente muito diferente do dos modelos clássicos. Em vez de falar de trajetórias bem definidas, falamos de distribuições de probabilidade e estados quânticos.
O átomo moderno não pode ser imaginado classicamente devido à sua natureza probabilística e não local. No entanto, representações simbólicas e esquemáticas podem ajudar a visualizar certos aspectos do átomo moderno. Os orbitais atômicos, as nuvens de probabilidade e os níveis de energia podem fornecer uma imagem mais completa do átomo moderno.
N.B.:
O termo "não local" no contexto da mecânica quântica e do átomo moderno refere-se a um fenômeno onde as propriedades de uma partícula podem ser influenciadas instantaneamente por eventos que ocorrem a uma distância arbitrária, sem que haja uma transmissão de informação por um meio clássico.