Los átomos son estables cuando el número de neutrones en el núcleo es aproximadamente igual al número de protones. Cuando esta diferencia es demasiado grande, el átomo se vuelve inestable.
Los núcleos pesados de isotopos ricos en neutrones con un número atómico mayor que el del hierro (N = 26) se ensamblan a temperaturas muy altas (>109 K) durante la explosión de estrellas masivas (supernovas).
Sin embargo, todos los núcleos buscan una estabilidad energética más económica. Por lo tanto, para regresar a un estado estable, deben transmutar expulsando energía en forma de masa o radiación. Esto lleva a la desintegración espontánea del núcleo, conocida como radiactividad.
La radiactividad es, por lo tanto, un fenómeno natural aleatorio que ocurre en el núcleo, en lo más profundo del átomo, y da lugar a un nuevo núcleo más estable.
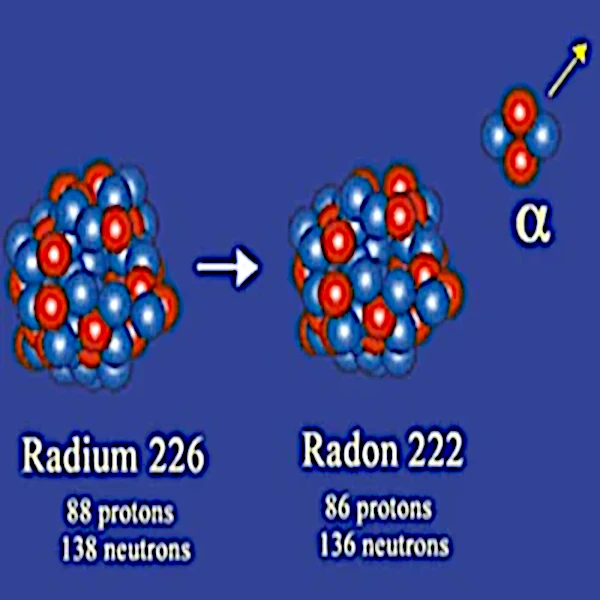
En 1908, Ernest Rutherford (1871-1937) identificó las partículas alfa como núcleos de helio-4 compuestos de 2 protones y 2 neutrones. Así, el núcleo estable resultante de la desintegración radiactiva tiene dos neutrones y dos protones menos que el núcleo inestable del cual se originó.
La emisión de una partícula alfa afecta principalmente a núcleos muy grandes como el del radio-226 (88 protones y 138 neutrones), el torio-232 (90 protones y 142 neutrones), el uranio-238 (92 protones y 136 neutrones), etc.
Tales núcleos son inestables porque la repulsión coulombiana entre protones, que aumenta como el cuadrado del número de protones, es más fuerte que la atracción nuclear entre nucleones. En este momento, el núcleo expulsa un paquete de cuatro nucleones.
Para la materia, esta es la forma más rápida y económica de recuperar la estabilidad.
El radio no tiene isótopos estables. El isótopo predominante del radio, descubierto por Pierre y Marie Curie el 21 de diciembre de 1898 al extraerlo de la pechblenda (mineral de uranio), es el radio-226, cuyo período radiactivo o vida media es de 1,600 años (tiempo necesario para que la mitad de los núcleos inicialmente presentes se transformen en otros núcleos).
El radio tiene propiedades naturales sorprendentes (radioluminiscencia, producción espontánea de calor, fuente radiactiva, etc.). Además, hace que la atmósfera sea conductora de electricidad y descarga capacitores a distancia, lo que permitió el desarrollo del contador Geiger-Müller. El contador Geiger, desarrollado en 1928, se utiliza para medir una amplia gama de radiaciones ionizantes (radiación alfa, beta, gamma y rayos X).
El radio se utilizó hasta 1950 por sus propiedades de radioluminiscencia, especialmente en pinturas destinadas a la relojería. A partir de la década de 1920, se identificaron enfermedades profesionales en las trabajadoras que refinaban sus pinceles de pintura enriquecida con radio llevándolos a la boca. Estas enfermedades llevaron a una primera investigación epidemiológica y al cierre progresivo de las fábricas.
Debido a su gran masa y carga, las partículas alfa tienen baja penetración. Generalmente pueden ser detenidas por la piel. Sin embargo, si se ingieren, se vuelven peligrosas. Dosis suficientemente altas pueden causar cáncer.
Nota: La ionización es el proceso de eliminar o agregar cargas electromagnéticas a un átomo.