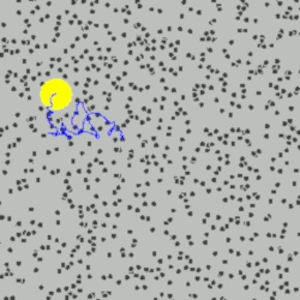
Descripción de la imagen: Simulación del Movimiento Browniano (en azul) de una partícula de polen (en amarillo), en suspensión en un fluido, moviéndose aleatoriamente por los movimientos frenéticos de las moléculas (en negro).
Robert Brown (1773-1858), botánico escocés y amigo de Charles Darwin (1809-1882), descubrió en 1827, al observar al microscopio granos de polen en suspensión en agua, que los granos de polen no permanecían inmóviles, sino que se movían continuamente de manera errática sin una razón aparente. Para confirmar que el movimiento no estaba relacionado específicamente con el polen vivo, Brown repitió el experimento con sustancias inanimadas, como fragmentos de polvo y partículas inorgánicas muy pequeñas. Para su gran sorpresa, observó que estas partículas inertes también mostraban el mismo movimiento aleatorio. Brown documentó este fenómeno con precisión, pero no entendió su origen.
Durante décadas, muchos físicos repitieron el experimento con microscopios cada vez más sofisticados, eliminando todos los sesgos de medición (corrientes de aire en la habitación, corrientes en el agua en la que están los granos de polen, vibraciones, perturbaciones por la luz, etc.), pero ninguno encontró explicaciones para esta agitación natural.
La teoría cinética molecular tiene sus raíces en los trabajos de varios científicos del siglo XIX. Fue formulada y desarrollada principalmente por tres físicos destacados: Rudolf Clausius (1822-1888), James Clerk Maxwell (1831-1879) y Ludwig Boltzmann (1844-1906).
La teoría cinética molecular proponía un modelo para explicar las propiedades macroscópicas de la materia en términos de partículas extremadamente pequeñas, llamadas "moléculas" o "corpusculares". Aunque el concepto de átomo aún no había sido probado experimentalmente en ese momento, los científicos postulaban la existencia de diminutas entidades invisibles para dar cuenta de fenómenos como la presión, la temperatura y el estado gaseoso.
La teoría cinética se basa en la idea de que toda la materia está constituida por entidades en movimiento constante. En este momento, la existencia de átomos seguía siendo controvertida, pero los científicos consideraban la idea de estas partículas como útil para explicar fenómenos observables. Por ejemplo, la presión ejercida por un gas resulta de las colisiones incesantes de las partículas del gas contra las paredes del recipiente. Cuantas más y más rápidas son las partículas, mayor es la presión. La temperatura se interpreta como proporcional a la energía cinética media de las partículas en movimiento. Así, un gas más caliente contiene partículas que se mueven más rápidamente.
Sin la confirmación de la existencia de átomos, la teoría cinética molecular seguía siendo un modelo abstracto. La idea de moléculas en movimiento fue aceptada por algunos como una descripción matemática, pero otros científicos se mantenían escépticos, considerando estas partículas como entidades hipotéticas sin fundamento experimental directo.
En 1905, la realidad física de los átomos y moléculas recibió una validación más amplia, ofreciendo una base sólida para la teoría cinética molecular. El artículo de Albert Einstein, publicado el 11 de mayo de 1905, titulado "Sobre el movimiento de partículas en suspensión en un fluido en reposo implicado por la teoría cinética molecular del calor", trata sobre el movimiento browniano. Einstein busca establecer un vínculo entre el movimiento browniano y la teoría cinética molecular, que describe las propiedades de los gases y líquidos en términos de movimientos moleculares.
Einstein parte de la idea de que en el movimiento browniano, las partículas en suspensión son continuamente bombardeadas por las moléculas del fluido circundante. El movimiento de las partículas se debe a los impactos desiguales de estas moléculas, que actúan de manera aleatoria pero constante.
Einstein desarrolla una ecuación que describe cuantitativamente este movimiento aleatorio. Relaciona el desplazamiento medio de las partículas con el tiempo, la temperatura del fluido, la viscosidad del fluido y el tamaño de las partículas (polen).
La Modelización Matemática es ⟨x2⟩ = 2kB Tt/6πηr donde ⟨x2⟩ es la distancia cuadrática media recorrida por una partícula (polen) después de un tiempo t, �������� es la constante de Boltzmann, ���� es la temperatura absoluta del fluido, ���� es la viscosidad del fluido, ���� es el radio de la partícula. Esta ecuación conecta las propiedades microscópicas (como la agitación térmica de las moléculas) con las observaciones macroscópicas (el movimiento observable de partículas de polen u otras).
Einstein demuestra que el movimiento browniano permite verificar experimentalmente la existencia de átomos y moléculas, que aún se debatían en ese momento. El movimiento de las partículas observadas corresponde exactamente a lo que predice la teoría cinética molecular. Albert Einstein no determina directamente el tamaño de un átomo en su artículo, pero establece bases que permitirán explorar la naturaleza atómica de la materia.
Jean Perrin (1870-1942), un físico francés, realizó una serie de experimentos en 1908-1909 para verificar las predicciones de Einstein. Al medir los desplazamientos de las partículas de resina en suspensión en agua bajo un microscopio, Perrin observa que los resultados son coherentes con los cálculos de Einstein, confirmando la relación entre el movimiento de las partículas y las colisiones moleculares.
A nivel microscópico, el movimiento browniano es causado por interacciones entre moléculas invisibles (como las moléculas de agua) que se mueven rápidamente y de manera caótica. Estas moléculas interactúan con las partículas en suspensión, provocando movimientos aparentemente aleatorios. A nivel macroscópico, el movimiento browniano es observable a simple vista (con un microscopio) a través del comportamiento de las partículas en suspensión. Por ejemplo, los granos de polen pueden verse moviéndose de manera errática en una gota de agua.
En resumen, el movimiento browniano actúa como un puente entre el mundo microscópico y el mundo macroscópico. Ilustra cómo eventos a escala atómica y molecular pueden traducirse en comportamientos medibles y predecibles a escalas más amplias, reforzando nuestra comprensión de los fenómenos físicos en diferentes niveles.