Die Geschichte beginnt im späten 18. Jahrhundert, als der britische Wissenschaftler William Nicholson (1753-1815) entdeckte, dass Wasser mithilfe von Elektrizität in Wasserstoff und Sauerstoff zerlegt werden kann. Doch erst zu Beginn des 19. Jahrhunderts wurde der Grundstein für die moderne Brennstoffzelle gelegt.
Im Jahr 1839 erfand der britische Physiker William Grove (1811-1896) die erste funktionierende Brennstoffzelle, die sogenannte Grove-Zelle. Es nutzte Wasserstoff als Brennstoff und Sauerstoff als Oxidationsmittel und erzeugte als Reaktionsprodukte Wasser und Elektrizität.
In den folgenden Jahrzehnten leisteten mehrere Chemiker bedeutende Beiträge zur Brennstoffzellentechnologie, darunter Francis Thomas Bacon (1904–1992), Wilhelm Ostwald (1853–1932), Karl Kordesch (1922–2011).
Im Jahr 1889 entwickelte der deutsche Forscher Ludwig Mond (1839-1909) eine gasbasierte Brennstoffzelle, die Kohlenmonoxid als Brennstoff nutzte.
Im Jahr 1965 war die Weltraummission Gemini 5 die erste, die eine Protonenaustauschmembran-Brennstoffzelle (PEMFC) an Bord ihres Raumschiffs einsetzte.
Seitdem wurden verschiedene Arten von Brennstoffzellen entwickelt, darunter Alkali-, PEMFC-, Festoxid- und Schmelzkarbonat-Brennstoffzellen, die jeweils Vorteile in verschiedenen Bereichen wie Raumfahrt, Elektrofahrzeugen, Notstromversorgungssystemen und stationären Anwendungen bieten.
Die Verwendung des Begriffs „Brennstoffzelle“ betont den elektrochemischen Prozess, der im Inneren des Geräts abläuft, und nicht die spezifische Art des verwendeten Brennstoffs. Die Brennstoffzelle liefert kontinuierlich Strom, solange sie in Echtzeit mit Brennstoff und Oxidationsmittel versorgt wird. Im Gegensatz zu Batterien speichert die Brennstoffzelle keine elektrische Energie und muss daher nicht aufgeladen werden. Für den weiteren Gebrauch ist es jedoch notwendig, den Kraftstoff sachgerecht zu lagern und zu transportieren.
Der Begriff „Brennstoff“ wird im Allgemeinen verwendet, um verschiedene Arten von Brennstoffen zu umfassen, die verwendet werden können, wie etwa Wasserstoff (H2), Methanol (CH3OH), Methan (CH4), Propan (C3H8), Synthesegas, eine Mischung aus Kohlenmonoxid (CO) und Wasserstoff (H2) usw. Die allgemeine Terminologie „Brennstoffzelle“ ermöglicht die Einbeziehung weiterer chemischer Verbindungen in der Zukunft.
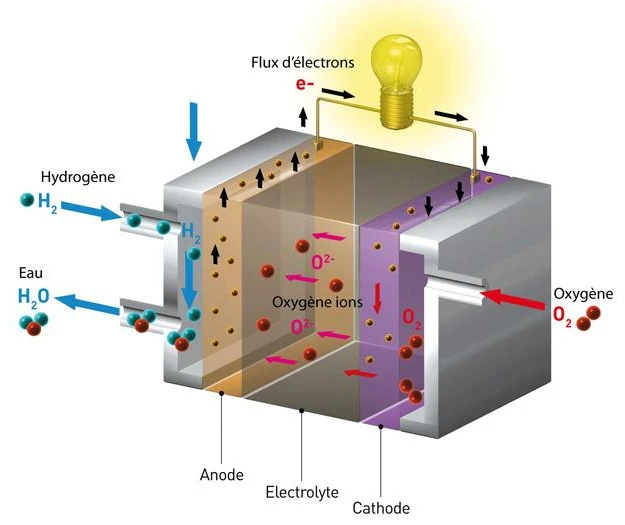
Wasserstoff-Sauerstoff-Brennstoffzellen, auch Protonenaustauschmembran-Brennstoffzellen (PEMFC) genannt, erfordern eine kontinuierliche Versorgung mit Wasserstoff und Sauerstoff.
Wasserstoff wird der Anode (negative Elektrode) zugeführt, während Sauerstoff (häufig Luft) der Kathode (positive Elektrode) zugeführt wird.
Die beiden Elektroden sind durch eine ionenleitende Polymermembran, einen sogenannten Elektrolyten, getrennt.
An der Anode zerfällt Wasserstoff durch eine Dissoziationsreaktion, die durch ein Material wie Platin katalysiert wird, in Wasserstoffionen (H+-Protonen) und Elektronen (e-). Der Katalysator an der Anode erleichtert diese Reaktion (2H2 → 4H+ + 4e-).
Die Protonen werden dann durch die Protonenaustauschmembran (PEM) zur Kathode transportiert, während die Elektronen gezwungen werden, durch einen externen Stromkreis zu fließen, wodurch ein elektrischer Strom entsteht, der zur Stromversorgung elektrischer Geräte verwendet werden kann.
Auf diese Weise liefern die Elektronen Elektrizität und verbinden sich dann mit der Kathode, wo sie an der Reduktionsreaktion mit Protonen und Sauerstoff zur Bildung von Wasser teilnehmen.
Der Katalysator an der Kathode, meist mit anderen Metallen legiertes Platin, erleichtert diese Reaktion (O2 + 4H+ + 4e- → 2H2O).
Das an der Kathode erzeugte Wasser sowie überschüssiger, nicht verbrauchter Wasserstoff und Sauerstoff werden in Form von Wasserdampf und Luft aus der Brennstoffzelle abgegeben. Die allgemeine Gleichung für die chemische Reaktion in einer Wasserstoff-Sauerstoff-Brennstoffzelle lautet 2H2 (Wasserstoff) + O2 (Sauerstoff) → 2H2O (Wasser).
Wasserstoff ist das am häufigsten vorkommende Element im Universum, auf der Erde ist er jedoch nicht als freier Wasserstoff verfügbar. Es kann jedoch aus verschiedenen Quellen (Wasserelektrolyse, Kohlenwasserstoffreformierung usw.) hergestellt werden.
Wasserstoff-Sauerstoff-Brennstoffzellen sind äußerst energieeffizient, was bedeutet, dass sie einen Großteil der in Wasserstoffbrückenbindungen enthaltenen chemischen Energie in Elektrizität umwandeln können.
Diese Brennstoffzellen können zwischen 40 % und 60 % der chemischen Energie von Wasserstoff in nutzbaren Strom umwandeln. Der Rest der Energie wird als Wärme abgegeben. Zum Vergleich: Der Wirkungsgrad herkömmlicher Verbrennungsmotoren liegt zwischen 25 % und 40 %.
In Wasser ist die Bindungsenergie im Vergleich zu anderen molekularen Bindungsenergien relativ hoch. Durch die Wechselwirkung zwischen den Wasserstoffatomen und dem Sauerstoffatom entsteht eine polarisierte kovalente Bindung. Diese Polarität verstärkt die Wechselwirkung zwischen den Atomen und erhöht dadurch die Bindungsenergie. Im Wassermolekül ist Sauerstoff elektronegativer als Wasserstoff, was bedeutet, dass er gemeinsam genutzte Elektronen in der Bindung stärker anzieht, wodurch eine negative Teilladung des Sauerstoffs und eine positive Teilladung des Wasserstoffs entsteht. Die durchschnittliche kovalente Bindungsenergie zwischen dem Wasserstoffatom und dem Sauerstoffatom beträgt etwa 460 Kilojoule pro Mol (kJ/mol). Ein Teil dieser Energie wird durch den elektrochemischen Reaktionsprozess in der Brennstoffzelle in elektrische Energie umgewandelt.
Daher gilt Wasserstoff aufgrund seines hohen Potenzials hinsichtlich Energieeffizienz und Emissionsreduzierung als idealer Brennstoff für Brennstoffzellen.