物語は、英国の科学者ウィリアム・ニコルソン (1753-1815) が電気を使用すると水を水素と酸素に分解できることを発見した 18 世紀後半に始まります。 しかし、現代の燃料電池の基礎が築かれたのは 19 世紀初頭でした。
1839 年、英国の物理学者ウィリアム グローブ (1811 ~ 1896) は、グローブ セルとして知られる最初の実用的な燃料電池を発明しました。 燃料として水素、酸化剤として酸素を使用し、反応生成物として水と電気を生成しました。
その後数十年間、フランシス・トーマス・ベーコン(1904~1992)、ヴィルヘルム・オストワルド(1853~1932)、カール・コルデシュ(1922~2011)といった数人の化学者が燃料電池技術に多大な貢献を果たした。
1889 年、ドイツの研究者ルートヴィヒ モンド (1839-1909) は、一酸化炭素を燃料として使用するガスベースの燃料電池を開発しました。
1965 年のジェミニ 5 号宇宙ミッションでは、宇宙船に陽子交換膜燃料電池 (PEMFC) が初めて使用されました。
以来、アルカリ電池、PEMFC電池、固体酸化物電池、溶融炭酸塩電池など、さまざまな種類の燃料電池が開発され、宇宙、電気自動車、緊急バックアップシステム、定置用途など、さまざまな分野で利点を発揮しています。
「燃料電池」という用語の使用は、使用される特定の種類の燃料ではなく、デバイス内で発生する電気化学プロセスを強調しています。 燃料電池は、燃料と酸化剤がリアルタイムで供給される限り、電力を供給し続けます。 電池とは異なり、燃料電池は電気エネルギーを蓄積しないため、再充電する必要がありません。 ただし、継続して使用するには燃料を適切に保管および輸送する必要があります。
「燃料」という用語は、一般に、水素 (H2)、メタノール (CH3OH)、メタン (CH4)、プロパン (C3H8)、合成ガス、一酸化炭素 (CO) と水素 (H2) の混合物など、使用できるさまざまな種類の燃料を包含するために使用されます。 「燃料電池」という一般的な用語には、将来的に他の化合物が含まれる可能性があります。
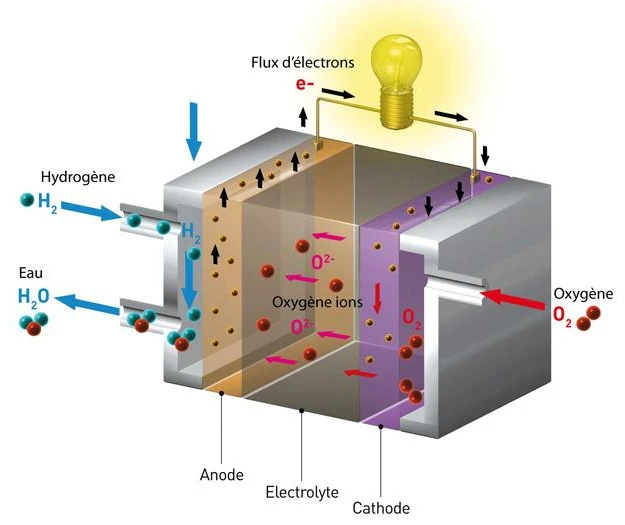
水素酸素燃料電池は、陽子交換膜燃料電池 (PEMFC) としても知られ、水素と酸素の継続的な供給を必要とします。
水素はアノード (負極) に供給され、酸素 (多くの場合空気) はカソード (正極) に供給されます。
2 つの電極は、電解質と呼ばれるイオン伝導性高分子膜によって分離されています。
アノードでは、白金などの材料の触媒による解離反応により、水素が水素イオン (H+ プロトン) と電子 (e-) に分解されます。 アノードの触媒はこの反応 (2H2 → 4H+ + 4e-) を促進します。
次に、陽子は陽子交換膜 (PEM) を通って陰極に輸送され、電子は外部回路を強制的に流れ、電気機器に電力を供給するために使用できる電流を生成します。
したがって、電子は電気を供給し、その後陰極に結合し、そこで陽子および酸素による還元反応に参加して水を形成します。
通常、他の金属と合金化された白金であるカソードの触媒は、この反応 (O2 + 4H+ + 4e- → 2H2O) を促進します。
カソードで生成された水、および消費されなかった過剰な水素と酸素は、水蒸気と空気の形で燃料電池から排出されます。 水素酸素燃料電池における化学反応の一般式は、2H2 (水素) + O2 (酸素) → 2H2O (水) です。
水素は宇宙で最も豊富な元素ですが、地球上では自由な水素として入手できません。 ただし、さまざまなソース (水の電気分解、炭化水素改質など) から生成できます。
水素酸素燃料電池はエネルギー効率が高く、水素結合に含まれる化学エネルギーの多くを電気に変換できます。
これらの燃料電池は、水素の化学エネルギーの 40% ~ 60% を使用可能な電気に変換できます。 残りのエネルギーは熱として放散されます。 ちなみに、従来の内燃エンジンの効率は 25% ~ 40% です。
水中では、他の分子の結合エネルギーに比べて結合エネルギーが比較的高くなります。 水素原子と酸素原子の間の相互作用により、分極した共有結合が形成されます。 この極性により原子間の相互作用が強化され、結合エネルギーが増加します。 水の分子では、酸素は水素よりも電気陰性度が高く、結合内の共有電子をより強く引き付け、酸素に負の部分電荷を生成し、水素に正の部分電荷を生成します。 水素原子と酸素原子の間の平均共有結合エネルギーは、1 モルあたり約 460 キロジュール (kJ/mol) です。 このエネルギーの一部は、燃料電池内の電気化学反応プロセスを通じて電気エネルギーに変換されます。
したがって、水素は、エネルギー効率と排出削減の点で高い可能性があるため、燃料電池にとって理想的な燃料と考えられています。