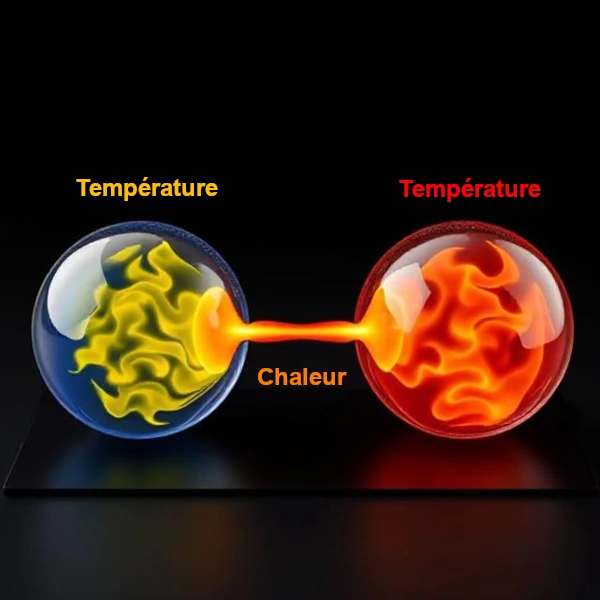
物理学において、熱と温度は関連する 2 つの概念ですが、根本的には異なります。
温度は、物体、物質、または環境がどれだけ熱いか冷たいかを示す物理的な測定値です。 それは物質を構成する微細な粒子(原子または分子)の平均運動エネルギーに直接関係しており、粒子が速く動くほど温度は高くなります。
温度は強力な量です。温度は系のサイズ (質量、体積、物質の量) には依存せず、系がいくつかの同一の部分に分割されている場合でも一定のままです。 国際システムではケルビン (K) で表されます。
たとえば、理想気体では、分子の平均運動エネルギーは \(\frac{3}{2}kT\) に比例します。ここで、\(k\) はボルツマン定数、\(T\) は温度です。 周囲温度 \(T = 300\,\text{K}\) の場合、このエネルギーは次の価値があります。 \[ \frac{3}{2}kT = \frac{3}{2} \times 1{,}38 \times 10^{-23}\,\text{J·K}^{-1} \times 300\,\text{K} \約 6{,}21 \times 10^{-21}\,\text{J} \] これは巨視的スケールでは非常に低いエネルギーですが、室温での分子の一定の撹拌を説明するには十分です。
熱は、2 つの熱力学システム間を移動するエネルギーの一種です。これは物体の固有の特性を表すものではなく、温度差によって伝達されるエネルギーの量を表します。この移動は伝導、対流、または放射によって発生し、熱平衡に達すると停止します。したがって、熱は相互作用に関係する量であり、孤立系の状態に関係するものではありません。
温度とは異なり、熱は膨大な量です(質量と材料に依存します)。これはジュール (J) で表され、交換中にのみ存在します。転送できるのは、伝導(直接の連絡先)、対流(流体の動き) または放射線(電磁波)。
比熱は、1 kg の材料の温度を 1 ケルビン (または 1 ℃) 上昇させるのに必要なエネルギー量を表します。 比熱の場合、絶対温度ではなく温度変化を考慮しているため、ケルビンと摂氏の差は無視できます。
材料の比熱が高いほど、その材料の所定の質量を加熱するためにより多くのエネルギーが必要となります。
| 材料 | 式 | 州 | 比熱 \(c\) (J・kg⁻¹・K⁻¹) |
|---|---|---|---|
| 水素 | H₂ | ガス | \(14300\) |
| 水 | H₂O | 液体 | \(4186\) |
| 氷 | H₂O | 固体 | \(2090\) |
| アルミニウム | アル | 固体 | \(900\) |
| 鉄 | 鉄 | 固体 | \(449\) |
| 銅 | 銅 | 固体 | \(385\) |
| 金 | で | 固体 | \(129\) |
参考文献: 『化学と物理学ハンドブック』CRC Press (2024)。
材料の温度を変化させるのに必要な熱量は、材料の温度によって異なります。比熱\(\,c\,\) (J·kg⁻¹·K⁻¹): \( Q = m \cdot c \cdot \Delta T \) ここで、\(Q\) は受け取った熱、\(m\) は物体の質量、\(c\) は比熱、\(\Delta T\) は温度変化です。
| コンセプト | 自然 | SI単位 | サイズ | 測定 |
|---|---|---|---|---|
| 温度 | 熱状態 | ケルビン(K) | 集中的な | 温度計 |
| 熱 | 輸送中のエネルギー | ジュール(J) | 広範囲にわたる | 熱量計 |
私たちは物体には「熱が含まれている」とよく言いますが、物理的な厳密さでは、熱は含まれておらず、熱はシステム間で交換されます。物体の熱状態を特徴付けるのはその温度ですが、内部エネルギーはその質量、温度、性質によって決まります。たとえば、バケツに入ったぬるま湯は、温度がはるかに低いにもかかわらず、真っ赤に熱した釘よりも総内部エネルギーが大きい可能性があります。
| 例 | 温度 | 質量 / 体積 | 伝わる熱 |
|---|---|---|---|
| 真っ赤に焼けた釘 vs バケツに入ったぬるま湯 | 高温の釘(約800℃)、ぬるま湯(約40℃) | 爪:非常に弱い 水:多め | 水中の総熱エネルギーが大きくなる |
| 同じ温度の 2 つの気球 | 同じ (同じ \(T\)) | 小さなボールと大きな風船 | 大きなバルーンはより多くの熱を伝えます |
| 異なる圧力の 2 つのタンク | 小型タンク: 非常に高圧 大型タンク:中圧 | 小容量と大容量 | 大型タンクからの移送量増加 |