Atome sind stabil, wenn die Anzahl der Neutronen im Atomkern ungefähr gleich der Anzahl der Protonen ist. Wenn der Unterschied zu groß ist, wird das Atom instabil.
Die schweren Kerne neutronenreicher Isotope mit höheren Ordnungszahlen als Eisen (N = 26) bilden sich bei sehr hohen Temperaturen (>109 K) während der Explosion massereicher Sterne (Supernovae).
Allerdings streben alle Kerne der Materie nach sparsamer energetischer Stabilität. Um in einen stabilen Zustand zurückzukehren, müssen sie sich umwandeln, indem sie Energie in Form von Masse oder Strahlung ausstoßen. Dies führt zum spontanen Zerfall des Kerns. Dies nennt man Radioaktivität.
Radioaktivität ist daher ein natürliches Zufallsphänomen, das im Kern, tief im Inneren des Atoms, auftritt und einen neuen, stabileren Kern entstehen lässt.
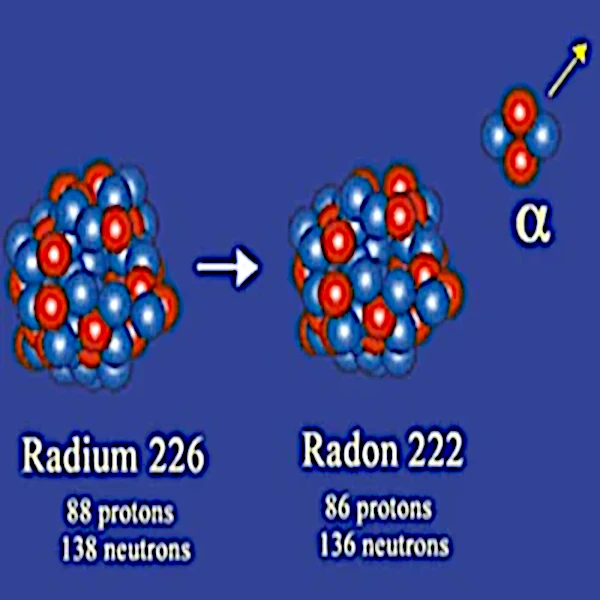
Im Jahr 1908 identifizierte Ernest Rutherford (1871-1937) Alphateilchen als Helium-4-Kerne, die aus 2 Protonen und 2 Neutronen bestehen. Somit hat der stabile Kern, der durch den radioaktiven Zerfall entsteht, zwei Neutronen und zwei Protonen weniger als der instabile Kern, aus dem er stammt.
Die Emission eines Alphateilchens betrifft hauptsächlich sehr große Kerne wie die von Radium-226 (88 Protonen und 138 Neutronen), Thorium-232 (90 Protonen und 142 Neutronen), Uran-238 (92 Protonen und 136 Neutronen) usw.
Solche Kerne sind instabil, weil die Coulomb-Abstoßung zwischen den Protonen, die mit dem Quadrat der Protonenzahl zunimmt, stärker ist als die nukleare Anziehung zwischen den Nukleonen. Dabei stößt der Kern eine Gruppe von vier Nukleonen aus.
Für das Material ist es die schnellste und wirtschaftlichste Möglichkeit, wieder Stabilität zu erlangen.
Radium hat keine stabilen Isotope. Das Hauptisotop von Radium, das Pierre und Marie Curie am 21. Dezember 1898 bei der Gewinnung von Pechblende (Uranerz) entdeckten, ist Radium-226, dessen radioaktive Periode oder Halbwertszeit 1.600 Jahre beträgt (die Zeit, die die Hälfte der ursprünglich vorhandenen Kerne benötigt, um andere Kerne hervorzubringen).
Radium verfügt über erstaunliche natürliche Eigenschaften (Radiolumineszenz, spontane Wärmeentwicklung, radioaktive Quelle usw.). Darüber hinaus macht es die Atmosphäre stromleitend und entlädt Kondensatoren aus der Ferne, was die Entwicklung des Geiger-Müller-Zählers ermöglichte. Der 1928 entwickelte Geigerzähler dient zur Messung einer Vielzahl ionisierender Strahlungen (Alpha-, Beta-, Gamma- und Röntgenstrahlung).
Radium wurde bis 1950 wegen seiner Radiolumineszenzeigenschaften insbesondere in Farben für die Uhrmacherei verwendet. Ab den 1920er Jahren wurden Berufskrankheiten bei Arbeitern festgestellt, die ihre mit Radium angereicherten Pinsel verfeinerten, indem sie sie in den Mund steckten. Diese Krankheiten führten zu einer ersten epidemiologischen Untersuchung und der schrittweisen Schließung der Fabriken.
Aufgrund ihrer großen Masse und Ladung haben Alphateilchen eine schlechte Durchdringung. Im Allgemeinen können sie durch die Haut gestoppt werden. Werden sie jedoch eingenommen, werden sie gefährlich. Ausreichend hohe Dosen können Krebs verursachen.
Hinweis: Bei der Ionisierung werden elektromagnetische Ladungen von einem Atom entfernt oder ihm hinzugefügt.