
Le monoxyde de carbone (CO) et le dioxyde de carbone (CO₂) sont deux composés simples du carbone et de l’oxygène, mais leurs propriétés physiologiques diffèrent radicalement. Alors que le CO est un gaz hautement toxique à très faible concentration, le CO₂ est un gaz produit en permanence par notre métabolisme, toléré dans certaines limites. Pourtant, la seule différence structurelle entre ces deux molécules est la présence d’un atome d’oxygène supplémentaire dans CO₂.
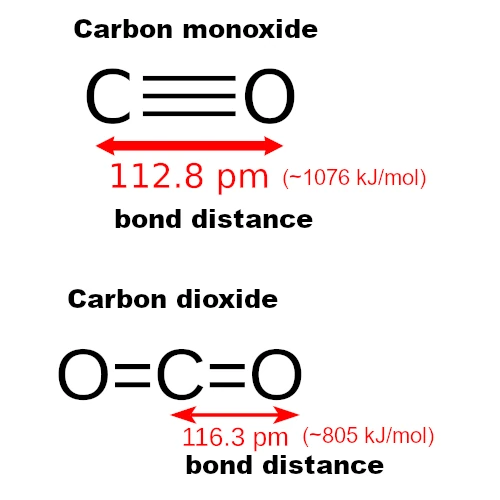
Le CO ne contient que deux atomes (carbone et oxygène), donc sa géométrie est linéaire (un seul axe d’alignement). Les atomes sont alignés en ligne droite : C–≡–O (deux atomes alignés).
Le CO₂, quant à lui, est aussi linéaire mais symétrique et non polaire, avec deux liaisons doubles : O=C=O (trois atomes en ligne droite).
Cette différence de structure modifie la réactivité chimique, l’interaction avec les biomolécules, et donc la toxicité physiologique.
La toxicité du CO provient de son affinité très forte pour l’hémoglobine, environ 230 à 300 fois supérieure à celle de l’oxygène. Une fois lié à l’hémoglobine pour former la carboxyhémoglobine (HbCO), le CO empêche l’O₂ de se fixer et altère sa libération dans les tissus, entraînant une hypoxie sévère. À 0,1 % (1000 ppm) de CO dans l’air, une personne peut perdre connaissance en quelques minutes.
En revanche, le CO₂ ne se fixe pas sur l’hémoglobine de la même manière. Il est produit dans les mitochondries lors de la respiration cellulaire, transporté partiellement sous forme de bicarbonate \( \text{HCO₃⁻} \), et expiré par les poumons. Ce gaz joue même un rôle clé dans la régulation du pH sanguin.
Bien qu’il soit un déchet métabolique, le dioxyde de carbone n’est pas intrinsèquement toxique en faibles concentrations. Néanmoins, lorsqu’il dépasse 2-3 %, il perturbe l’équilibre acido-basique en formant de l’acide carbonique \( \text{CO₂ + H₂O ⇌ H₂CO₃ ⇌ H⁺ + HCO₃⁻}\), ce qui mène à une acidose respiratoire. Ce n’est qu’au-delà de 5-8 % de CO₂ dans l’air que l'on observe des effets neurologiques graves et un risque vital.
Le CO₂ devient toxique pour l'organisme humain dès 2-3 %, avec des effets graves et potentiellement mortels au-delà de 5 % dans l'air respiré.
Un adulte au repos expire environ 200 mL de CO₂ par minute. Sur 8 heures de sommeil, chaque personne génère environ 90–100 L de CO₂ par nuit.
Prenons une chambre de 15 m² de surface 2,5 m de hauteur sous plafond, le volume total = 37 500 L. Le CO₂ expiré par une personne représente : \(\frac{100\ \text{L}}{37\,500\ \text{L}} = 0{,}0027 = 0{,}27\%\) Ajout de 0,27 % de CO₂ dans la pièce sur une nuit complète, sans ventilation.
L'air extérieur contient ~0,04 % de CO₂. En chambre fermée, avec 2 personnes, le taux peut monter entre 0,2 % et 0,5 % (soit 2000–5000 ppm). Ce niveau reste sous les seuils pathologiques (les premiers symptômes d'hypercapnie commencent vers 2-3 %).
Même avec plusieurs personnes, le CO₂ reste bien en-dessous des seuils toxiques pendant une nuit classique, sauf si la pièce est extrêmement petite, complètement étanche et sans aucune fuite d'air (ce qui est rare).
Une modification apparemment mineure dans la structure moléculaire – comme l'ajout ou le retrait d’un seul atome – peut entraîner des effets biochimiques profondément différents, voire opposés.
Cela montre à quel point les propriétés chimiques émergent de la structure moléculaire fine. Et cela souligne pourquoi la prédiction des interactions chimiques et biologiques est complexe : elle dépend non seulement des éléments présents, mais de leur agencement spatial, de la polarité, de la symétrie, des orbitales moléculaires…