
DERKohlenmonoxid(CO) und dieKohlendioxid(CO₂) sind zwei einfache Verbindungen aus Kohlenstoff und Sauerstoff, deren physiologische Eigenschaften sich jedoch grundlegend unterscheiden. Während CO in sehr geringen Konzentrationen ein hochgiftiges Gas ist, ist CO₂ ein Gas, das unser Stoffwechsel ständig produziert und in gewissen Grenzen toleriert. Der einzige strukturelle Unterschied zwischen diesen beiden Molekülen besteht jedoch in der Anwesenheit eines zusätzlichen Sauerstoffatoms im CO₂.
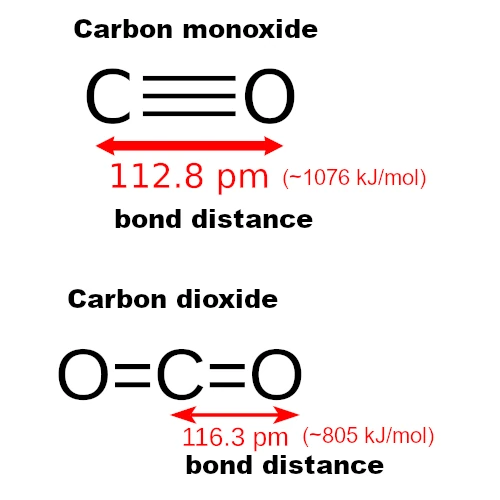
DERCOenthält nur zwei Atome (Kohlenstoff und Sauerstoff), daher ist seine Geometrie linear (eine einzige Ausrichtungsachse). Die Atome sind in einer geraden Linie ausgerichtet: C–≡–O (zwei Atome ausgerichtet).
DERCO₂ist seinerseits ebenfalls linear, aber symmetrisch und unpolar, mit zwei Doppelbindungen: O=C=O (drei Atome in einer geraden Linie).
Dieser Strukturunterschied verändert die chemische Reaktivität, die Wechselwirkung mit Biomolekülen und damit die physiologische Toxizität.
Die Toxizität von CO beruht auf seiner sehr starken Affinität zu Hämoglobin, die etwa 230 bis 300 Mal größer ist als die von Sauerstoff. Sobald CO an Hämoglobin gebunden ist und Carboxyhämoglobin (HbCO) bildet, verhindert es die Bindung von O₂ und beeinträchtigt dessen Freisetzung in das Gewebe, was zu schwerer Hypoxie führt. Bei 0,1 % (1000 ppm) CO in der Luft kann eine Person innerhalb von Minuten das Bewusstsein verlieren.
Andererseits bindet CO₂ nicht in gleicher Weise an Hämoglobin. Es wird in den Mitochondrien bei der Zellatmung produziert, teilweise als Bikarbonat \( \text{HCO₃⁻} \) transportiert und über die Lunge ausgeatmet. Dieses Gas spielt sogar eine Schlüsselrolle bei der Regulierung des Blut-pH-Wertes.
Obwohl es sich um einen Stoffwechselabfall handelt, ist Kohlendioxid in geringen Konzentrationen nicht grundsätzlich toxisch. Wenn es jedoch 2-3 % übersteigt, stört es das Säure-Basen-Gleichgewicht, indem es Kohlensäure \( \text{CO₂ + H₂O ⇌ H₂CO₃ ⇌ H⁺ + HCO₃⁻}\) bildet, was zu einer respiratorischen Azidose führt. Erst ab 5-8 % CO₂ in der Luft beobachten wir schwerwiegende neurologische Auswirkungen und ein lebenswichtiges Risiko.
Ab 2-3 % wird CO₂ für den menschlichen Körper giftig, bei mehr als 5 % in der Atemluft kann es schwerwiegende und potenziell tödliche Folgen haben.
Ein ruhender Erwachsener atmet etwa 200 ml CO₂ pro Minute aus. Bei 8 Stunden Schlaf erzeugt jeder Mensch pro Nacht etwa 90–100 Liter CO₂.
Nehmen wir einen Raum mit einer Fläche von 15 m² und einer Deckenhöhe von 2,5 m, das Gesamtvolumen = 37.500 L. Das von einer Person ausgeatmete CO₂ beträgt: \(\frac{100\ \text{L}}{37\,500\ \text{L}} = 0{,}0027 = 0{,}27\%\) Zugabe von 0,27 % CO₂ im Raum über eine ganze Nacht, ohne Lüftung.
Außenluft enthält ~0,04 % CO₂. In einem geschlossenen Raum mit 2 Personen kann die Rate zwischen 0,2 % und 0,5 % (also 2000–5000 ppm) ansteigen. Dieser Wert bleibt unterhalb der pathologischen Schwellenwerte (die ersten Symptome einer Hyperkapnie beginnen bei etwa 2–3 %).
Selbst bei mehreren Personen bleibt CO₂ in einer typischen Nacht deutlich unter den toxischen Grenzwerten, es sei denn, der Raum ist extrem klein, vollständig abgedichtet und weist keine Luftlecks auf (was selten vorkommt).
Eine scheinbar geringfügige Änderung der Molekülstruktur – etwa das Hinzufügen oder Entfernen eines einzelnen Atoms – kann zu völlig unterschiedlichen oder sogar gegensätzlichen biochemischen Wirkungen führen.
Dies zeigt, wie aus feinen Molekülstrukturen chemische Eigenschaften entstehen. Und dies unterstreicht, warum die Vorhersage chemischer und biologischer Wechselwirkungen komplex ist: Sie hängt nicht nur von den vorhandenen Elementen ab, sondern auch von deren räumlicher Anordnung, Polarität, Symmetrie, Molekülorbitalen usw.