
O monóxido de carbono (CO) e o dióxido de carbono (CO₂) são dois compostos simples de carbono e oxigênio, mas suas propriedades fisiológicas diferem radicalmente. Enquanto o CO é um gás altamente tóxico em concentrações muito baixas, o CO₂ é um gás produzido constantemente por nosso metabolismo, tolerado dentro de certos limites. No entanto, a única diferença estrutural entre essas duas moléculas é a presença de um átomo de oxigênio adicional no CO₂.
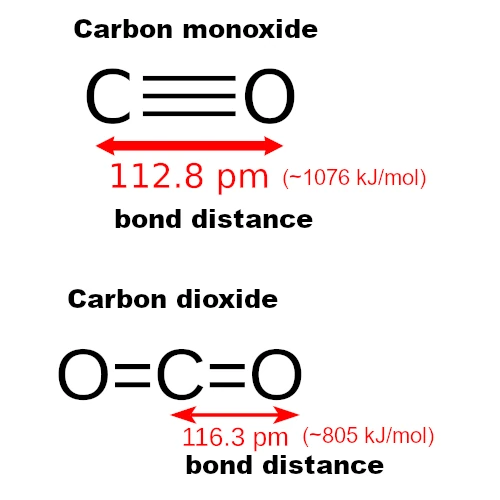
O CO contém apenas dois átomos (carbono e oxigênio), portanto, sua geometria é linear (um único eixo de alinhamento). Os átomos estão alinhados em linha reta: C–≡–O (dois átomos alinhados).
O CO₂, por outro lado, também é linear, mas simétrico e não polar, com duas ligações duplas: O=C=O (três átomos em linha reta).
Essa diferença estrutural altera a reatividade química, a interação com biomoléculas e, portanto, a toxicidade fisiológica.
A toxicidade do CO vem de sua afinidade muito forte pela hemoglobina, aproximadamente 230 a 300 vezes maior do que a do oxigênio. Uma vez ligado à hemoglobina para formar a carboxihemoglobina (HbCO), o CO impede que o O₂ se fixe e altera sua liberação nos tecidos, levando a uma hipóxia grave. Com 0,1% (1000 ppm) de CO no ar, uma pessoa pode perder a consciência em questão de minutos.
Por outro lado, o CO₂ não se fixa à hemoglobina da mesma maneira. É produzido nas mitocôndrias durante a respiração celular, transportado parcialmente na forma de bicarbonato \( \text{HCO₃⁻} \) e expelido pelos pulmões. Este gás até desempenha um papel-chave na regulação do pH sanguíneo.
Embora seja um resíduo metabólico, o dióxido de carbono não é intrinsecamente tóxico em baixas concentrações. No entanto, quando excede 2-3%, perturba o equilíbrio ácido-base ao formar ácido carbônico \( \text{CO₂ + H₂O ⇌ H₂CO₃ ⇌ H⁺ + HCO₃⁻}\), o que leva à acidose respiratória. É apenas acima de 5-8% de CO₂ no ar que efeitos neurológicos graves e risco vital são observados.
O CO₂ se torna tóxico para o organismo humano a partir de 2-3%, com efeitos graves e potencialmente fatais acima de 5% no ar respirado.
Um adulto em repouso expira aproximadamente 200 mL de CO₂ por minuto. Ao longo de 8 horas de sono, cada pessoa gera aproximadamente 90–100 L de CO₂ por noite.
Considere um quarto de 15 m² com uma altura de teto de 2,5 m, o volume total = 37.500 L. O CO₂ expirado por uma pessoa representa: \(\frac{100\ \text{L}}{37\,500\ \text{L}} = 0{,}0027 = 0{,}27\%\) Adição de 0,27% de CO₂ no quarto durante uma noite completa, sem ventilação.
O ar exterior contém ~0,04% de CO₂. Em um quarto fechado com 2 pessoas, o nível pode subir entre 0,2% e 0,5% (2000–5000 ppm). Este nível permanece abaixo dos limites patológicos (os primeiros sintomas de hipercapnia começam em torno de 2-3%).
Mesmo com várias pessoas, o CO₂ permanece bem abaixo dos níveis tóxicos durante uma noite típica, a menos que o quarto seja extremamente pequeno, completamente vedado e sem qualquer vazamento de ar (o que é raro).
Uma modificação aparentemente menor na estrutura molecular – como a adição ou remoção de um único átomo – pode levar a efeitos bioquímicos profundamente diferentes, até opostos.
Isso mostra o quanto as propriedades químicas emergem da estrutura molecular fina. E destaca por que a previsão das interações químicas e biológicas é complexa: depende não apenas dos elementos presentes, mas de seu arranjo espacial, polaridade, simetria, orbitais moleculares…