L'énergie de l'électron est l'énergie totale qu'il possède dans l'atome, déterminée par sa distance au noyau et son mouvement. Cette énergie ne peut prendre que des valeurs quantifiées spécifiques appelées niveaux d'énergie.
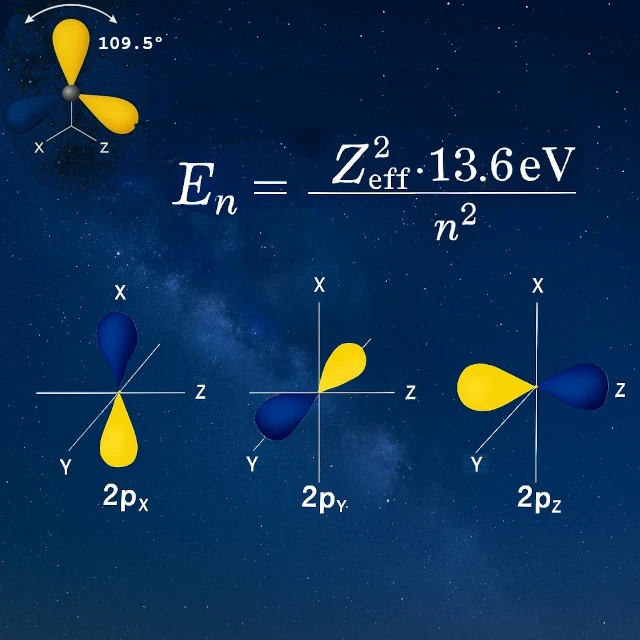
Prenons l'exemple de l'hydrogène, l'atome de référence en physique atomique. L'électron gagne de l'énergie en passant de l'état fondamental (-13,6 eV pour n=1) aux états excités (-3,4 eV, -1,51 eV, -0,85 eV…) jusqu'à l'ionisation complète à 0 eV. Ces niveaux se calculent tous par la formule En = -13,6/n², qui sert également de référence pour comparer les énergies de liaison des autres éléments.
Cette nature quantifiée de l'énergie électronique explique la diversité des éléments chimiques et leurs comportements. Sa compréhension est essentielle en chimie quantique, en science des matériaux, et dans de nombreux domaines comme la photosynthèse, la respiration cellulaire ou les cellules photovoltaïques.
Dans un atome polyélectronique, l'énergie d'un électron n'est pas simplement déterminée par sa distance au noyau, mais par une interaction complexe entre l'attraction du noyau et la répulsion des autres électrons. C'est cette énergie effective, subtilement modulée, qui dicte si un atome aura tendance à perdre, gagner ou partager des électrons, faisant ainsi émerger ses propriétés chimiques caractéristiques. Autrement dit, l'énergie électronique définit l'identité chimique d'un élément et sa manière d'interagir avec les autres atomes. Cela explique pourquoi le sodium réagit violemment avec l'eau tandis que le néon reste totalement inerte.
Pour illustrer concrètement comment l'énergie électronique détermine le comportement chimique, examinons le carbone (Z = 6), élément fondamental du vivant.
Sa configuration électronique 1s² 2s² 2p² montre que ses 6 électrons occupent trois niveaux d'énergie distincts : les 2 électrons de la couche 1s sont très fortement liés (basse énergie, -489,6 eV), ceux de la couche 2s ont une énergie intermédiaire, et les 2 électrons de valence en 2p sont faiblement liés (haute énergie, -30,6 eV), donc disponibles pour former des liaisons chimiques.
• Loin du noyau (couche externe) → Haute énergie (proche de 0 eV) → Facile à arracher → Réactif
• Proche du noyau (couche interne) → Basse énergie (très négatif) → Difficile à arracher → Inerte
Un électron de "haute énergie" (comme celui de la couche 2p à -30,6 eV) est faiblement lié au noyau : il suffit de fournir 30,6 eV pour l'arracher complètement. Inversement, un électron de "basse énergie" (comme celui de la couche 1s à -489,6 eV) est fortement lié : il faut fournir 489,6 eV pour le libérer.
Imaginez un objet en hauteur : plus il est haut, plus son énergie potentielle est grande et plus il peut tomber facilement. L'électron d'une orbitale "haute" est comme cet objet : il est "haut" sur l'échelle énergétique (peu stable) et "tombe" facilement (réagit) pour atteindre un état plus stable.
Dans son état isolé, le carbone possède deux électrons célibataires dans ses orbitales 2p (pₓ et pᵧ), ce qui suggérerait seulement deux liaisons possibles. Pourtant, le carbone forme quatre liaisons équivalentes. Comment ? Par un processus appelé hybridation sp³ : l'orbitale 2s fusionne avec les trois orbitales 2p pour créer quatre nouvelles orbitales hybrides identiques.
Avant hybridation (carbone isolé) :
Après hybridation sp³ :
Cette géométrie tétraédrique précise permet au carbone de former quatre liaisons fortes dans des directions bien définies. Contrairement à une répartition uniforme, les électrons de valence sont localisés dans des directions privilégiées à 109,5° les unes des autres. C'est cette tétravalence directionnelle qui fait du carbone l'architecte moléculaire du vivant, capable de construire des chaînes, des cycles et des structures tridimensionnelles d'une immense diversité, fondement de toute la chimie organique.
L'énergie des électrons transforme les mathématiques abstraites des orbitales en réalité chimique tangible. Les formes et orientations des orbitales déterminent la géométrie moléculaire, leurs énergies dictent la réactivité, et l'hybridation explique la diversité structurale de la matière vivante.
De l'hydrogène au carbone, du méthane à l'ADN, chaque molécule trouve son architecture dans la distribution énergétique de ses électrons. Cette compréhension fondamentale ne se limite pas à la théorie : elle guide la conception de médicaments, de catalyseurs, de semi-conducteurs et de matériaux innovants. L'énergie électronique est le pont entre la physique quantique et la chimie du monde réel.