Imaginez un instant que dans l'atome, l'électron ne soit plus une petite planète tournant sagement autour d'un noyau-soleil, mais une note de musique, une vibration, une onde. C'est cela, la révolution conceptuelle déclenchée par Erwin Schrödinger (1887-1961) en 1926.
L'équation de Schrödinger ne nous dit pas où se trouve l'électron avec certitude, mais où il est susceptible de se trouver. Elle transforme l'espace atomique possible en une piste de danse où les figures du danseur dessinent les orbitales probables.
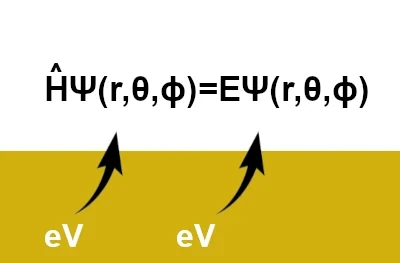
L'équation de Schrödinger s'écrit : \(\hat{H}\,\Psi(r,\theta,\phi)=E\,\Psi(r,\theta,\phi)\) où $(r, \theta, \phi)$ sont des coordonnées sphériques (r : La coordonnée radiale, θ : La coordonnée polaire, ϕ : La coordonnée azimutale). Cependant dans sa forme la plus simple, elle s'écrit : \( \hat{H} \Psi = E \Psi \)
Pour percer les mystères de l'atome, il faut une clé spéciale. Cette clé, c'est ce que les physiciens appellent la "fonction d'onde". On lui a donné un petit nom chic : Ψ (qui se lit "Psi", comme le début de "psyché" ou le trident de Neptune).
Imaginez que Ψ est une sorte de "carte de navigation" pour l'électron. Cette carte ne dit pas où va aller l'électron mais où il pourra aller. Plus exactement, elle décrit les endroits où vous avez des chances de le trouver, et les endroits où vous ne pourrez pas le trouver.
À gauche, \(\hat{H}\) représente "tout ce qui se passe dans l'atome" (l'attraction du noyau, l'énergie, les contraintes). À droite, \(E\) est le résultat : l'énergie que l'électron doit avoir pour être stable dans cette configuration.
Résoudre cette équation, c'est comme chercher la bonne note sur un piano pour qu'elle résonne parfaitement dans une pièce. On ne peut pas jouer n'importe quoi : seules certaines notes (les énergies \(E\)) et certaines manières de vibrer (les fonctions Ψ) fonctionnent harmonieusement.
Ce fut le grand dilemme des physiciens jusqu'à ce que Max Born (1882-1970) ait une intuition géniale. Il a dit : "Ne regardez pas Ψ elle-même, regardez son reflet, son carré, \(|\Psi|^2\)". C'est comme la fumée qui révèle un nuage de probabilité où l'objet était avant que le magicien le fasse disparaitre. Ainsi, \(|\Psi|^2\) nous indique, point par point dans l'espace autour du noyau, la probabilité de présence de l'électron.
En clair, là où \(|\Psi|^2\) est grand c'est le "jardin" de l'atome, là où l'électron passe son temps. Là où \(|\Psi|^2\) est nul, c'est un "désert", l'électron ne vient jamais. L'électron devient alors moins une bille qu'un nuage, une trainée de lumière, une danse floue et élégante autour du noyau appelée "orbitale".
Appliquée à l'atome d'hydrogène (un proton et un électron), l'équation de Schrödinger révèle une série de solutions, d'états quantiques, chacun caractérisé par trois nombres, souvent appelés nombres quantiques. Chaque solution correspond à une orbitale atomique, une forme géométrique tridimensionnelle spécifique qui est la "zone de danse" privilégiée de l'électron.
Là où Niels Bohr (1885-1962) voyait des électrons tournant sur des orbites circulaires bien rangées, comme des planètes autour du Soleil, l'équation de Schrödinger révèle un univers autrement plus riche et poétique. Les solutions dessinent dans l'espace des formes géométriques d'une élégante complexité.
Ces formes ne sont pas de simples fantaisies mathématiques. Elles sont la clé de voute de la chimie. La géométrie des orbitales détermine comment les atomes peuvent se lier entre eux pour former des molécules. La direction des orbitales p, par exemple, explique la forme angulaire de la molécule d'eau (H2O). La richesse des orbitales d est responsable des couleurs éclatantes des ions des métaux de transition. Ainsi, l'équation de Schrödinger, par ses solutions, est la grammaire cachée qui dicte la structure de toute la matière qui nous entoure.
N.B. :
L'image mentale du "nuage électronique" est plus juste que celle de la "particule en mouvement". Une orbitale est une carte de probabilité instantanée. Si vous preniez une photographie ultra-rapide de l'atome, vous verriez l'électron en un point ; en superposant des millions de ces photographies, vous verriez apparaitre la forme de l'orbitale, comme une trace de lumière laissée par un danseur sur une scène sombre.