A energia do elétron é a energia total que ele possui no átomo, determinada por sua distância do núcleo e seu movimento. Esta energia só pode assumir valores quantizados específicos chamados níveis de energia.
Tomemos o exemplo do hidrogênio, o átomo de referência em física atômica. O elétron ganha energia ao passar do estado fundamental (-13,6 eV para n=1) para os estados excitados (-3,4 eV, -1,51 eV, -0,85 eV…) até a ionização completa a 0 eV. Esses níveis são todos calculados pela fórmula En = -13,6/n², que também serve como referência para comparar as energias de ligação de outros elementos.
Esta natureza quantizada da energia eletrônica explica a diversidade dos elementos químicos e seus comportamentos. Sua compreensão é essencial em química quântica, ciência dos materiais e em muitos campos como fotossíntese, respiração celular ou células fotovoltaicas.
Em um átomo com vários elétrons, a energia de um elétron não é simplesmente determinada por sua distância do núcleo, mas por uma interação complexa entre a atração do núcleo e a repulsão dos outros elétrons. É esta energia efetiva, sutilmente modulada, que dita se um átomo tenderá a perder, ganhar ou compartilhar elétrons, dando origem às suas propriedades químicas características. Em outras palavras, a energia eletrônica define a identidade química de um elemento e sua maneira de interagir com outros átomos. Isso explica por que o sódio reage violentamente com a água, enquanto o néon permanece totalmente inerte.
Para ilustrar concretamente como a energia eletrônica determina o comportamento químico, examinemos o carbono (Z = 6), um elemento fundamental da vida.
Sua configuração eletrônica 1s² 2s² 2p² mostra que seus 6 elétrons ocupam três níveis de energia distintos: os 2 elétrons da camada 1s são muito fortemente ligados (baixa energia, -489,6 eV), aqueles da camada 2s têm energia intermediária, e os 2 elétrons de valência em 2p são fracamente ligados (alta energia, -30,6 eV), portanto disponíveis para formar ligações químicas.
• Longe do núcleo (camada externa) → Alta energia (próxima de 0 eV) → Fácil de remover → Reativo
• Próximo do núcleo (camada interna) → Baixa energia (muito negativa) → Difícil de remover → Inerte
Um elétron de "alta energia" (como o da camada 2p a -30,6 eV) está fracamente ligado ao núcleo: basta fornecer 30,6 eV para removê-lo completamente. Por outro lado, um elétron de "baixa energia" (como o da camada 1s a -489,6 eV) está fortemente ligado: são necessários 489,6 eV para libertá-lo.
Imagine um objeto em altura: quanto mais alto, maior sua energia potencial e mais fácil ele cai. O elétron de um orbital "alto" é como esse objeto: está "alto" na escala energética (pouco estável) e "cai" facilmente (reage) para atingir um estado mais estável.
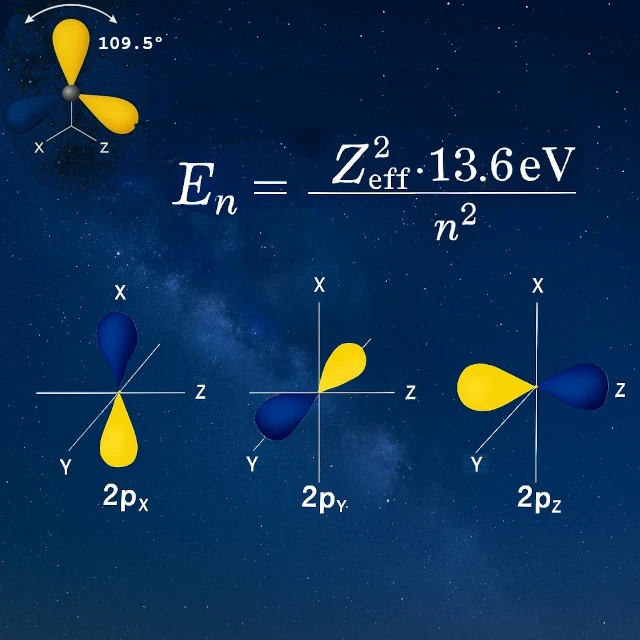
Em seu estado isolado, o carbono possui dois elétrons desemparelhados em seus orbitais 2p (pₓ e pᵧ), o que sugeriria apenas duas ligações possíveis. No entanto, o carbono forma quatro ligações equivalentes. Como? Por um processo chamado hibridização sp³: o orbital 2s se funde com os três orbitais 2p para criar quatro novos orbitais híbridos idênticos.
Antes da hibridização (carbono isolado):
Após a hibridização sp³:
Esta geometria tetraédrica precisa permite ao carbono formar quatro ligações fortes em direções bem definidas. Ao contrário de uma distribuição uniforme, os elétrons de valência estão localizados em direções privilegiadas a 109,5° uns dos outros. Esta tetravalência direcional faz do carbono o arquiteto molecular da vida, capaz de construir cadeias, ciclos e estruturas tridimensionais de uma diversidade imensa, base de toda a química orgânica.
A energia dos elétrons transforma a matemática abstrata dos orbitais em realidade química tangível. As formas e orientações dos orbitais determinam a geometria molecular, suas energias ditam a reatividade, e a hibridização explica a diversidade estrutural da matéria viva.
Do hidrogênio ao carbono, do metano ao DNA, cada molécula encontra sua arquitetura na distribuição energética de seus elétrons. Esta compreensão fundamental não se limita à teoria: ela guia o projeto de medicamentos, catalisadores, semicondutores e materiais inovadores. A energia eletrônica é a ponte entre a física quântica e a química do mundo real.