La energía del electrón es la energía total que posee en el átomo, determinada por su distancia al núcleo y su movimiento. Esta energía solo puede tomar valores cuantificados específicos llamados niveles de energía.
Tomemos el ejemplo del hidrógeno, el átomo de referencia en física atómica. El electrón gana energía al pasar del estado fundamental (-13,6 eV para n=1) a los estados excitados (-3,4 eV, -1,51 eV, -0,85 eV…) hasta la ionización completa a 0 eV. Estos niveles se calculan todos mediante la fórmula En = -13,6/n², que también sirve como referencia para comparar las energías de enlace de otros elementos.
Esta naturaleza cuantificada de la energía electrónica explica la diversidad de los elementos químicos y sus comportamientos. Su comprensión es esencial en química cuántica, ciencia de materiales y muchos campos como la fotosíntesis, la respiración celular o las células fotovoltaicas.
En un átomo con múltiples electrones, la energía de un electrón no está determinada simplemente por su distancia al núcleo, sino por una interacción compleja entre la atracción del núcleo y la repulsión de otros electrones. Esta energía efectiva, sutilmente modulada, dicta si un átomo tenderá a perder, ganar o compartir electrones, dando lugar así a sus propiedades químicas características. En otras palabras, la energía electrónica define la identidad química de un elemento y su forma de interactuar con otros átomos. Esto explica por qué el sodio reacciona violentamente con el agua mientras que el neón permanece totalmente inerte.
Para ilustrar concretamente cómo la energía electrónica determina el comportamiento químico, examinemos el carbono (Z = 6), un elemento fundamental de la vida.
Su configuración electrónica 1s² 2s² 2p² muestra que sus 6 electrones ocupan tres niveles de energía distintos: los 2 electrones de la capa 1s están muy fuertemente unidos (baja energía, -489,6 eV), los de la capa 2s tienen una energía intermedia, y los 2 electrones de valencia en 2p están débilmente unidos (alta energía, -30,6 eV), por lo que están disponibles para formar enlaces químicos.
• Lejos del núcleo (capa externa) → Alta energía (cerca de 0 eV) → Fácil de arrancar → Reactivo
• Cerca del núcleo (capa interna) → Baja energía (muy negativa) → Difícil de arrancar → Inerte
Un electrón de "alta energía" (como el de la capa 2p a -30,6 eV) está débilmente unido al núcleo: basta con aportar 30,6 eV para arrancarlo por completo. Por el contrario, un electrón de "baja energía" (como el de la capa 1s a -489,6 eV) está fuertemente unido: se necesitan 489,6 eV para liberarlo.
Imagina un objeto en altura: cuanto más alto está, mayor es su energía potencial y más fácil es que caiga. El electrón de un orbital "alto" es como este objeto: está "alto" en la escala energética (poco estable) y "cae" fácilmente (reacciona) para alcanzar un estado más estable.
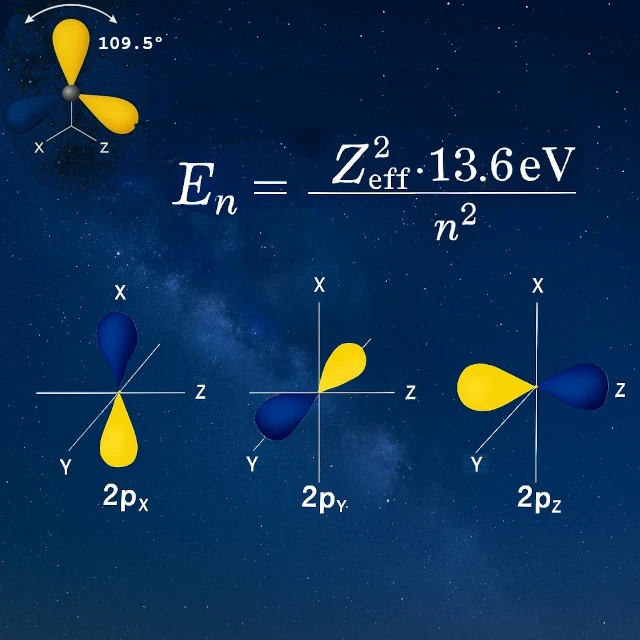
En su estado aislado, el carbono tiene dos electrones desapareados en sus orbitales 2p (pₓ y pᵧ), lo que sugeriría solo dos enlaces posibles. Sin embargo, el carbono forma cuatro enlaces equivalentes. ¿Cómo? Mediante un proceso llamado hibridación sp³: el orbital 2s se fusiona con los tres orbitales 2p para crear cuatro nuevos orbitales híbridos idénticos.
Antes de la hibridación (carbono aislado):
Después de la hibridación sp³:
Esta geometría tetraédrica precisa permite al carbono formar cuatro enlaces fuertes en direcciones bien definidas. A diferencia de una distribución uniforme, los electrones de valencia están localizados en direcciones privilegiadas a 109,5° entre sí. Esta tetravalencia direccional convierte al carbono en el arquitecto molecular de la vida, capaz de construir cadenas, ciclos y estructuras tridimensionales de una diversidad inmensa, base de toda la química orgánica.
La energía de los electrones transforma las matemáticas abstractas de los orbitales en realidad química tangible. Las formas y orientaciones de los orbitales determinan la geometría molecular, sus energías dictan la reactividad, y la hibridación explica la diversidad estructural de la materia viva.
Del hidrógeno al carbono, del metano al ADN, cada molécula encuentra su arquitectura en la distribución energética de sus electrones. Esta comprensión fundamental no se limita a la teoría: guía el diseño de medicamentos, catalizadores, semiconductores y materiales innovadores. La energía electrónica es el puente entre la física cuántica y la química del mundo real.