画像の説明: 時間に依存しないシュレーディンガー方程式を解くと、原子状態の量子化エネルギーなどの物理値を取得できます。 ハミルトニアン演算子 (Ĥ) は、量子系の総エネルギーを表すため、特に重要です。この演算子を波動関数に適用すると、この状態に関連付けられたエネルギーが得られます。 これら 2 つの項のバランスが粒子の動作を決定します。 原子物理学では、エネルギーを電子ボルト、1eV=1.602×10で表します。−19ジュール。
シュレーディンガー方程式は、1925 年にエルヴィン シュレーディンガー (1887-1961) によって表現され、原子の構造を理解する上で中心的な役割を果たします。これにより、原子内の電子の量子状態を記述し、各電子層およびサブシェルに関連するエネルギー準位を決定することが可能になります。このアプローチは量子力学に基づいており、古典的な記述とは根本的に異なります。
この方程式を解くと、原子の離散エネルギー準位を計算できます。
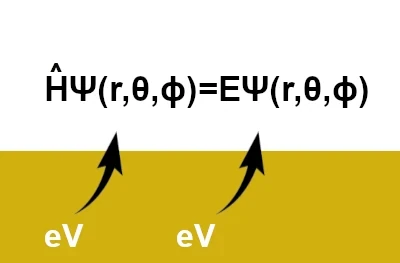
$$\hat{H} \Psi(r, \theta, \phi) = E \Psi(r, \theta, \phi)$$
注: :
量子力学では、電子は原子核の周りに球状の確率分布を持っているため、原子は球状座標で記述されることが多く、原子軌道の形状と方向を記述するのに非常に役立ちます。
その中の電子のエネルギーは、水素原子(水素H+、ヘリウム He+、リチウム李2+、ベリリウム3+、など)を数値化します。エネルギーは Z と主量子数 n に依存します。
$$E_n = -13.6 \, \text{eV} \times \frac{Z^2}{n^2}$$
ザ単電子イオン電子を 1 つだけ持ち、他の電子はすべて取り除かれたイオンです。これらのイオンは、イオン化システムの研究を簡素化するために理論モデルでよく使用されます。電子はさまざまな量子化エネルギー レベル (1、2、3 などの n の値が考えられます) で見つけることができます。
水素原子をイオン化する、つまり電子を放出するには、この結合を切断するために少なくとも 13.6 eV のエネルギーを水素原子に与える必要があります。 炭素原子をイオン化する、つまり電子を放出するには、この結合を切断するために少なくとも 489.6 eV のエネルギーを炭素原子に与える必要があります。 したがって、電子が原子核に近づくほど、エネルギーはより負になります。
この文脈における負のエネルギーは、電子が原子に結合しており、一定量のエネルギーが供給されないと原子から逃げることができないという事実を反映しています。 電子は原子核に引き寄せられるため、位置エネルギーは負になります。電子が原子核に近づくほど、このエネルギーはより負になります(つまり、原子はより安定します)。 一方、電子の運動エネルギーも、電子の速度と電子をその軌道上に維持する力との関係により負になります。
あ負のエネルギー電子が原子核に結合しており、電子を原子核から引き離すには正のエネルギー (イオン化エネルギーと呼ばれる) を提供する必要があることを示します。
ザ量子数原子内の電子の状態を記述するために使用されるパラメータです。大きく分けて4つあります。 これらの量子数により、原子内の電子の状態を完全に特徴付け、そのエネルギー レベルと空間内での構造を決定することが可能になります。
ザおむつは、同じ主量子数 n を持つ軌道のセットです。
ザ下敷きは、同じ n と同じ l を持つ軌道のサブセットです。 したがって、サブシェルは二次量子数 $l$ によって決定されます。
| Shell (n) | Electrons / shell (2n²) | Subshell | Electrons / subshell | Orbitals / subshell |
|---|---|---|---|---|
| 1 | 2 | 1s | 2 | 1 |
| 2 | 8 | 2s 2p |
2 6 |
1 3 |
| 3 | 18 | 3s 3p 3d |
2 6 10 |
1 3 5 |
| 4 | 32 | 4s 4p 4d 4f |
2 6 10 14 |
1 3 5 7 |
Examples of electronic structures:
シュレディンガー方程式は、シェルやサブシェル内の電子のエネルギー準位を含む原子の構造を正確に記述することができます。この量子アプローチは、元素の発光スペクトルと吸収スペクトル、および原子核の周りの電子の配置で観察される挙動を説明します。