画像の説明: 圧力、体積、温度の関係は、理想気体の法則によって説明されます。たとえば、一定の体積で温度が低下すると、圧力も低下します。
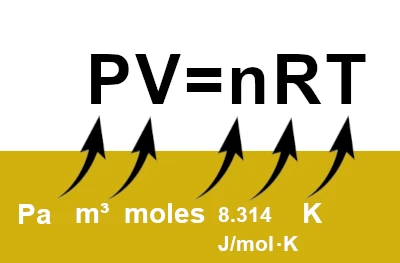
理想気体の法則または方程式は、熱力学の最も基本的なものの 1 つです。気体を説明するために、圧力 (\(P\))、体積 (\(V\))、温度 (\(T\))、気体の量 (\(n\)) という 4 つの重要な変数を関連付けます。
理想気体方程式を使用すると、理想気体の挙動をモデル化できます。理想気体とは、粒子が衝突以外の相互作用を受けない気体です。このモデルは、現実の気体が理想気体とほぼ同じように動作する、中程度の温度と圧力における有効な近似です。
この方程式から、特定の量の気体 (\(n\)) と一定の温度 (\(T\)) において、圧力と体積は反比例の関係にあることがわかります。これは、ガスの温度と量が一定であれば、体積を増やすと圧力が下がり、その逆も成り立つことを意味します。
自転車のポンプを使用すると、空気を圧縮するときにポンプ内のガス圧が増加します。観測された熱効果、つまりポンプの加熱は、理想気体の法則の直接の結果です。
ポンプを作動させると、ポンプ内のガスの体積を減らそうとする力が働きます。理想気体の方程式によれば、気体量 (n) とモル数を一定に保ちながら体積 (V) が減少すると、圧力 (P) は増加する必要があります。 気体が圧縮されると、熱の形でエネルギーが放出されます。
特に夏場、冷蔵庫のドアをしばらく開けておくと開けにくくなる現象は、理想ガスの法則で説明できます。
冷蔵庫のドアをしばらく開けたままにしておくと、冷蔵庫内の空気が周囲の暖かい空気と混ざります。この熱風の混合によって冷蔵庫内の温度が上昇します。 ドアを閉めると冷蔵庫内のガスは再び冷え始め、圧力が下がります。しかし、外気が閉めたドアにさらに圧力をかけるため、ドアを開けるのが難しくなります。
熱いジャム瓶を閉めた後に逆さまにすると、瓶の中の空気が急速に冷却されます。冷めると鍋の中の空気が収縮します。
理想気体の法則によれば、一定の体積で温度が低下すると、鍋内の圧力も低下します。これは、ガスが運動エネルギーを失い、空気分子が占めるスペースが少なくなるためです。この温度と圧力の低下により、ポットの内部には外部の大気圧に対して負圧が生じます。 この負圧により、鍋を逆さにするとわずかに「パチッ」という音が聞こえ、蓋がわずかに内側に変形します。これは、外圧が鍋内部の圧力よりも高いために起こります。 この現象は完全な真空ではなく、蓋の周りに一種の気密シールを形成する弱い負圧です。
理想気体方程式は、圧力が気体の温度と体積に直接関係していることを示しています。沸騰した水の場合、水の表面から水蒸気が蒸発します。水蒸気の圧力が大気圧に等しいとき、沸点に達し、蒸発によってこの沸点が維持されます。
高地では、海面に比べて気圧が低下します。これは水の沸点に影響を与え、周囲の圧力と密接に関係しています。 高地では気圧が低いため、水はより低い温度で沸騰します。たとえば、標高 2,000 メートルでは水は約 93 ℃で沸騰し、標高 4,000 メートルでは 86 ℃で沸騰します。
パスタの茹で具合は、茹でる時の水の温度によって決まります。高地では水の沸騰温度が低くなるため、パスタを茹でる温度も低くなります。 水は海面で見られる高い温度(100℃)に達することができないため、高地でのパスタの調理には時間がかかります。
圧力鍋の仕組みは、圧力、温度、体積の関係など、理想気体の法則を使って説明できます。
圧力鍋は鍋内の圧力を高めることで内部の水が沸騰する温度を上げます。水が加熱されると、その温度が上昇し、水蒸気が圧力鍋内の圧力を高めます。
一定の温度で圧力を上げると(蓋を閉めているので体積は一定のまま)、水の沸騰温度も上昇します。言い換えれば、圧力鍋では、水は沸騰し始める前に100℃を超える温度に達する可能性があります。たとえば、約 2 bar (大気圧の 2 倍) の圧力では、水は約 120°C で沸騰します。
理想気体の法則は、気体 (またはここでは水蒸気) が沸騰する温度は圧力に直接依存することを示しています。 高圧では、水分子が液体から気体 (蒸気) 状態に変化するのに十分なエネルギーを持つ温度が上昇します。
方程式 \(PV = nRT\) は、気体の挙動についてのシンプルかつ強力な見方を提供します。すべての場合 (たとえば、高圧または低温の気体) に適用できるわけではありませんが、熱力学の多くの研究の基礎を形成し、物理学者や技術者にとって依然として基本的なツールです。