Bildbeschreibung: Der Zusammenhang zwischen Druck, Volumen und Temperatur wird durch das ideale Gasgesetz beschrieben. Sinkt beispielsweise die Temperatur bei konstantem Volumen, sinkt auch der Druck.
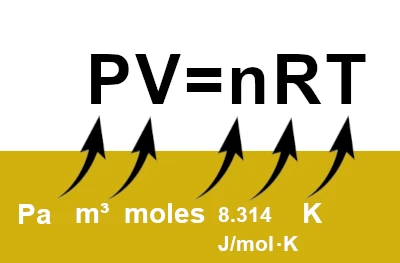
Das ideale Gasgesetz oder die ideale Gasgleichung ist eines der grundlegendsten in der Thermodynamik. Es verknüpft vier wichtige Variablen zur Beschreibung eines Gases: Druck (\(P\)), Volumen (\(V\)), Temperatur (\(T\)) und Gasmenge (\(n\)).
Die ideale Gasgleichung ermöglicht es, das Verhalten idealer Gase zu modellieren, bei denen es sich um Gase handelt, deren Teilchen außer Kollisionen keine Wechselwirkungen miteinander eingehen. Dieses Modell ist eine gültige Näherung bei moderater Temperatur und mittlerem Druck, wo sich reale Gase fast wie ideale Gase verhalten.
Die Gleichung sagt uns, dass für eine gegebene Gasmenge (\(n\)) und eine konstante Temperatur (\(T\)) Druck und Volumen in einem umgekehrten Verhältnis zueinander stehen. Das bedeutet, dass bei einer Volumenvergrößerung der Druck abnimmt und umgekehrt, sofern Temperatur und Gasmenge konstant bleiben.
Wenn Sie eine Fahrradpumpe verwenden, erhöht sich der Gasdruck in der Pumpe, wenn Sie die Luft komprimieren. Der beobachtete thermische Effekt, nämlich die Erwärmung der Pumpe, ist eine direkte Folge des idealen Gasgesetzes.
Wenn Sie die Pumpe betreiben, üben Sie eine Kraft aus, um das Gasvolumen in der Pumpe zu verringern. Gemäß der idealen Gasgleichung muss der Druck (P) ansteigen, wenn das Volumen (V) abnimmt, während die Gasmenge (n) und die Molzahl konstant bleiben. Beim Komprimieren eines Gases wird Energie in Form von Wärme freigesetzt.
Das Phänomen, dass sich die Kühlschranktür nach längerem Offenstehen, insbesondere im Sommer, nur schwer öffnen lässt, lässt sich durch das ideale Gasgesetz erklären.
Wenn Sie die Kühlschranktür längere Zeit geöffnet lassen, vermischt sich die Luft im Kühlschrank mit der warmen Umgebungsluft. Dieses Heißluftgemisch erhöht die Temperatur im Kühlschrank. Wenn Sie die Tür schließen, beginnt das Gas im Kühlschrank wieder abzukühlen und sein Druck nimmt ab. Allerdings übt die Außenluft einen größeren Druck auf die geschlossene Tür aus, was das Öffnen der Tür erschwert.
Wenn man ein heißes Marmeladenglas nach dem Verschließen auf den Kopf stellt, kühlt die Luft im Glas schnell ab. Beim Abkühlen zieht sich die Luft im Topf zusammen.
Nach dem idealen Gasgesetz sinkt bei konstantem Volumen auch der Druck im Topf, wenn die Temperatur sinkt. Dies geschieht, weil das Gas kinetische Energie verliert und die Luftmoleküle weniger Platz beanspruchen. Durch diese Reduzierung der Temperatur und des Drucks entsteht im Topf ein Unterdruck gegenüber dem äußeren Atmosphärendruck. Durch diesen Unterdruck ist beim Umdrehen der Kanne ein leichtes „Knacken“ zu hören und der Deckel verformt sich leicht nach innen. Dies geschieht, weil der Außendruck größer ist als der Druck im Topf. Bei diesem Phänomen handelt es sich nicht um ein perfektes Vakuum, sondern um einen schwachen Unterdruck, der eine Art hermetische Abdichtung um den Deckel herum erzeugt.
Die ideale Gasgleichung zeigt, dass der Druck in einem Gas direkt mit der Temperatur und dem Volumen zusammenhängt. Bei kochendem Wasser entweicht Wasserdampf an der Wasseroberfläche. Wenn der Druck des Wasserdampfs dem atmosphärischen Druck entspricht, wird der Siedepunkt erreicht und durch Verdampfung wird diese Siedetemperatur aufrechterhalten.
In der Höhe nimmt der Luftdruck im Vergleich zum Druck auf Meereshöhe ab. Dies beeinflusst den Siedepunkt von Wasser, der eng mit dem Umgebungsdruck verknüpft ist. In großen Höhen ist der Luftdruck niedriger, sodass Wasser bei einer niedrigeren Temperatur kocht. Beispielsweise siedet Wasser in 2000 Metern Höhe bei etwa 93 °C und in 4000 Metern Höhe bei 86 °C.
Wie gut die Nudeln garen, hängt von der Temperatur ab, die das Wasser beim Kochen behält. Da Wasser in der Höhe bei einer niedrigeren Temperatur kocht, ist auch die Temperatur, bei der Nudeln gekocht werden, niedriger. Da Wasser die höheren Temperaturen auf Meereshöhe (100 °C) nicht erreichen kann, ist das Garen von Nudeln in der Höhe langsamer.
Die Funktionsweise des Schnellkochtopfs lässt sich anhand des idealen Gasgesetzes erklären, einschließlich des Zusammenhangs zwischen Druck, Temperatur und Volumen.
Ein Schnellkochtopf funktioniert, indem er den Druck im Topf erhöht, wodurch die Temperatur steigt, bei der das Wasser im Inneren kochen kann. Wenn das Wasser erhitzt wird, steigt seine Temperatur und der Wasserdampf erzeugt einen zunehmenden Druck im Schnellkochtopf.
Wenn wir bei konstanter Temperatur den Druck erhöhen (das Volumen bleibt seit dem Schließen des Deckels konstant), erhöht sich auch die Siedetemperatur des Wassers. Mit anderen Worten: Im Schnellkochtopf kann das Wasser eine Temperatur von mehr als 100 °C erreichen, bevor es zu kochen beginnt. Beispielsweise siedet Wasser bei einem Druck von etwa 2 Bar (doppelter Atmosphärendruck) bei etwa 120 °C.
Das ideale Gasgesetz zeigt uns, dass die Temperatur, bei der ein Gas (oder hier Wasserdampf) siedet, direkt vom Druck abhängt. Bei höherem Druck steigt die Temperatur, bei der Wassermoleküle genug Energie haben, um vom flüssigen in den gasförmigen (Dampf-)Zustand überzugehen.
Die Gleichung \(PV = nRT\) bietet eine einfache, aber aussagekräftige Sicht auf das Verhalten von Gasen. Obwohl es nicht in allen Fällen anwendbar ist (z. B. für Gase bei hohem Druck oder niedriger Temperatur), bildet es die Grundlage vieler Studien zur Thermodynamik und bleibt ein grundlegendes Werkzeug für Physiker und Ingenieure.