Die Elektronenenergie ist die Gesamtenergie, die ein Elektron in einem Atom besitzt, bestimmt durch seinen Abstand zum Kern und seine Bewegung. Diese Energie kann nur bestimmte quantisierte Werte annehmen, die als Energieniveaus bezeichnet werden.
Nehmen wir Wasserstoff, das Referenzatom in der Atomphysik. Das Elektron gewinnt Energie, indem es vom Grundzustand (-13,6 eV für n=1) in angeregte Zustände (-3,4 eV, -1,51 eV, -0,85 eV…) übergeht, bis zur vollständigen Ionisation bei 0 eV. Diese Niveaus werden alle mit der Formel En = -13,6/n² berechnet, die auch als Referenz für den Vergleich der Bindungsenergien anderer Elemente dient.
Diese quantisierte Natur der Elektronenenergie erklärt die Vielfalt der chemischen Elemente und ihr Verhalten. Ihr Verständnis ist in der Quantenchemie, Materialwissenschaft und vielen Bereichen wie Photosynthese, Zellatmung oder Photovoltaikzellen essenziell.
In einem Mehrelektronenatom wird die Energie eines Elektrons nicht einfach durch seinen Abstand zum Kern bestimmt, sondern durch eine komplexe Wechselwirkung zwischen der Anziehung des Kerns und der Abstoßung der anderen Elektronen. Diese effektive Energie, subtil moduliert, bestimmt, ob ein Atom dazu neigt, Elektronen zu verlieren, zu gewinnen oder zu teilen, und bringt so seine charakteristischen chemischen Eigenschaften hervor. Mit anderen Worten: Die Elektronenenergie definiert die chemische Identität eines Elements und seine Art der Interaktion mit anderen Atomen. Dies erklärt, warum Natrium heftig mit Wasser reagiert, während Neon völlig inert bleibt.
Um konkret zu veranschaulichen, wie die Elektronenenergie das chemische Verhalten bestimmt, betrachten wir Kohlenstoff (Z = 6), ein grundlegendes Element des Lebens.
Seine Elektronenkonfiguration 1s² 2s² 2p² zeigt, dass seine 6 Elektronen drei verschiedene Energieniveaus besetzen: Die 2 Elektronen der 1s-Schale sind sehr stark gebunden (niedrige Energie, -489,6 eV), die der 2s-Schale haben eine mittlere Energie, und die 2 Valenzelektronen in 2p sind schwach gebunden (hohe Energie, -30,6 eV) und daher für die Bildung chemischer Bindungen verfügbar.
• Fern vom Kern (äußere Schale) → Hohe Energie (nahe 0 eV) → Leicht zu entfernen → Reaktiv
• Nah am Kern (innere Schale) → Niedrige Energie (sehr negativ) → Schwer zu entfernen → Inert
Ein Elektron mit "hoher Energie" (wie das in der 2p-Schale bei -30,6 eV) ist schwach an den Kern gebunden: Es sind nur 30,6 eV nötig, um es vollständig zu entfernen. Umgekehrt ist ein Elektron mit "niedriger Energie" (wie das in der 1s-Schale bei -489,6 eV) stark gebunden: Es sind 489,6 eV erforderlich, um es zu befreien.
Stellen Sie sich ein Objekt in der Höhe vor: Je höher es ist, desto größer ist seine potenzielle Energie und desto leichter fällt es. Ein Elektron in einem "hohen" Orbital ist wie dieses Objekt: Es ist "hoch" auf der Energieskala (weniger stabil) und "fällt" leicht (reagiert), um einen stabileren Zustand zu erreichen.
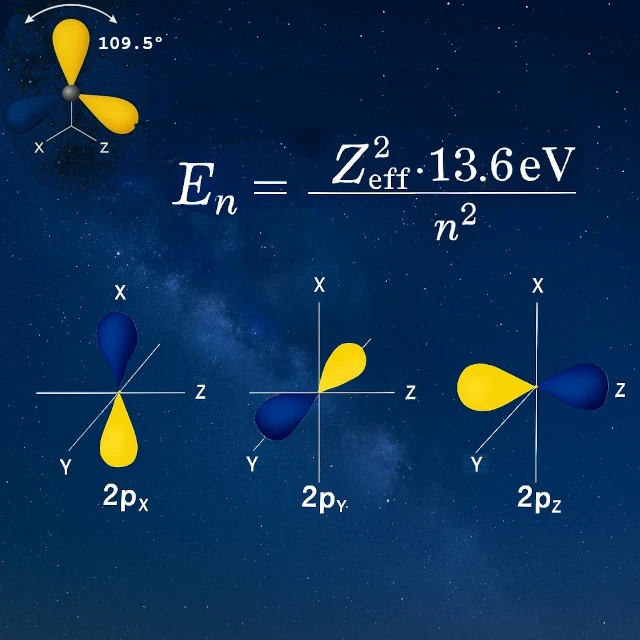
In seinem isolierten Zustand besitzt Kohlenstoff zwei ungepaarte Elektronen in seinen 2p-Orbitalen (pₓ und pᵧ), was nur zwei mögliche Bindungen nahelegen würde. Doch Kohlenstoff bildet vier äquivalente Bindungen. Wie? Durch einen Prozess namens sp³-Hybridisierung: Das 2s-Orbital verschmilzt mit den drei 2p-Orbitalen, um vier neue, identische Hybridorbitale zu schaffen.
Vor der Hybridisierung (isolierter Kohlenstoff):
Nach der sp³-Hybridisierung:
Diese präzise tetraedrische Geometrie ermöglicht es Kohlenstoff, vier starke Bindungen in klar definierten Richtungen zu bilden. Im Gegensatz zu einer gleichmäßigen Verteilung sind die Valenzelektronen in bevorzugten Richtungen bei 109,5° zueinander lokalisiert. Diese gerichtete Tetravalenz macht Kohlenstoff zum molekularen Architekten des Lebens, der Ketten, Zyklen und dreidimensionale Strukturen von immenser Vielfalt aufbauen kann, die Grundlage der gesamten organischen Chemie.
Die Elektronenenergie verwandelt die abstrakte Mathematik der Orbitale in greifbare chemische Realität. Die Formen und Ausrichtungen der Orbitale bestimmen die Molekülgeometrie, ihre Energien diktieren die Reaktivität, und die Hybridisierung erklärt die strukturelle Vielfalt der lebenden Materie.
Vom Wasserstoff zum Kohlenstoff, vom Methan zur DNA – jedes Molekül findet seine Architektur in der energetischen Verteilung seiner Elektronen. Dieses grundlegende Verständnis bleibt nicht auf die Theorie beschränkt: Es leitet die Entwicklung von Medikamenten, Katalysatoren, Halbleitern und innovativen Materialien. Die Elektronenenergie ist die Brücke zwischen der Quantenphysik und der Chemie der realen Welt.