La luz es la única información que los científicos tienen a su disposición para comprender el mundo que nos rodea. A lo largo de los siglos, los científicos han hecho "hablar" a la luz.
En 1670, Isaac Newton (1643-1727) observó la luz blanca del Sol a través de un prisma de vidrio y se dio cuenta de que este haz de luz se descomponía. Pensó que la luz estaba compuesta de corpúsculos.
En 1676, Ole Christensen Rømer (1644-1681) determinó la velocidad de la luz observando los satélites de Júpiter.
En 1690, Christian Huygens (1629-1695) enunció que la luz está constituida por una serie de ondas propagadas a través del éter, un sustrato inmaterial que sirve de soporte en el vacío para transportar la luz.
En 1801, Thomas Young (1773-1829) obtuvo una figura de interferencia (imagen adyacente), mostrando que la luz es una onda porque las ondas pueden sumarse y restarse para crear interferencias (zonas oscuras entrecortadas por zonas luminosas). Este experimento ayuda a comprender el comportamiento y la naturaleza de la luz.
En 1814, Joseph Von Fraunhofer (1787-1826) notó líneas en la luz visible del espectro solar. Este óptico y físico alemán fue el primero en estudiar la difracción de la luz utilizando redes ópticas (difracción de Fraunhofer). En esa época, no se conocía la razón de la presencia de estas líneas en el espectro visible de la luz. La respuesta llegaría mucho más tarde.
En 1850, Robert Wilhelm Bunsen (1811-1899) y Gustav Robert Kirchhoff (1824-1887) descubrieron que las líneas espectrales de la luz emitida por un cuerpo incandescente constituyen una firma que permite identificar este cuerpo. Al observar el espectro de la luz solar, reconocieron varios elementos químicos presentes en la Tierra, incluyendo el cesio y el rubidio.
En 1864, James Clerk Maxwell (1831-1879) hizo una síntesis de las ondas eléctricas y electromagnéticas. Determinó que la luz es una onda electromagnética y que todo el espectro electromagnético es luz. Lo que diferencia a las ondas electromagnéticas entre sí es la longitud de onda. Las diferentes ventanas del espectro electromagnético se caracterizan por un rango de longitudes de onda pero también por un rango de frecuencias.
En 1900, Max Planck resolvió el enigma del cuerpo negro; su fórmula describe perfectamente la luz emitida por un cuerpo en función de su temperatura. En otras palabras, una temperatura alta indica una alta energía, una temperatura baja indica una baja energía.
En 1905, Albert Einstein (1879-1955) explicó el efecto fotoeléctrico; son los fotones de la luz incidente los que arrancan electrones de la materia.
Los fotones actúan como cuantos de energía, lo que Planck ya había sugerido, pero fue Einstein quien lo demostró. Estos fotones, por lo tanto, tienen cierta energía, que arrancará los electrones del metal. Cuando recibimos los rayos luminosos del Sol en nuestra piel, sentimos la energía que transportan.
La luz está, por lo tanto, compuesta de fotones con comportamiento ondulatorio, y cada uno de estos fotones corresponde a una energía. Cuanto más corta es la longitud de onda del fotón, más energético es.
En 1911, Ernest Rutherford (1871-1937) especificó la estructura del átomo y dio un tamaño al núcleo atómico del orden de 10-14 metros.
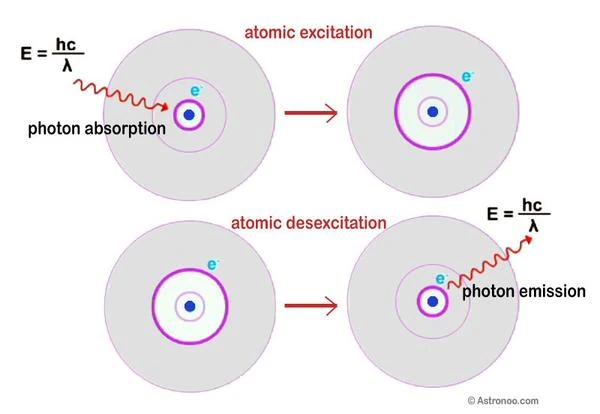
En 1913, Niels Bohr (1885-1962) propuso la estructura del átomo de hidrógeno; los electrones están situados en órbitas cuantificadas. El electrón navega a cierta distancia, en una de las capas en cebolla alrededor del núcleo. Este es el principio de absorción y emisión de luz en un átomo.
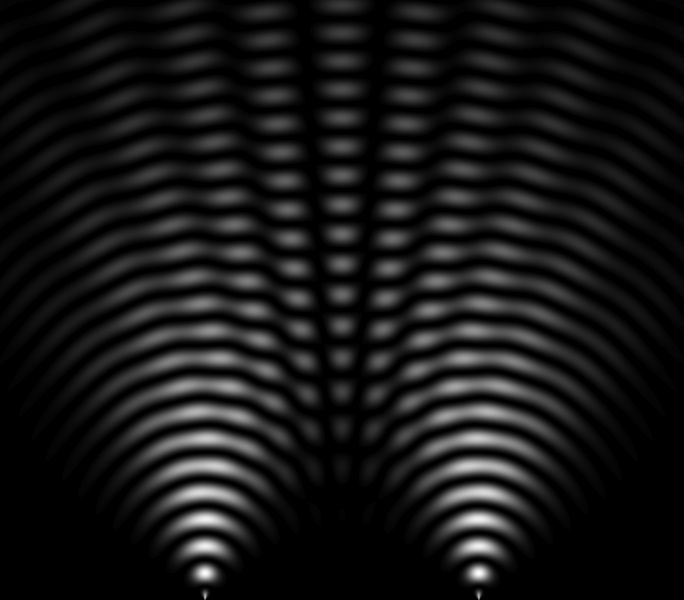
En 1821, Thomas Young (1773-1829), el famoso experimento de las "rendijas de Young" consiste en hacer interferir dos haces de luz de la misma fuente. Este experimento realizado con fotones se ha llevado a cabo desde entonces con todas las partículas. Con electrones en la década de 1920, con neutrones en la década de 1950, con átomos en la década de 1980 y con moléculas en la década de 1990.
N.B.:
Energía del fotón E = hν = hc / λ. E es la energía expresada en julios, h es la constante de Planck (6,62 x 10-34), ν es la frecuencia (número de oscilaciones electromagnéticas), c es la velocidad de la luz en el vacío y λ es la longitud de onda. La energía de un fotón es, por lo tanto, infinitamente pequeña. En otras palabras, cuanto más corta es la longitud de onda, mayor es la frecuencia y mayor es la energía.