La lumière est la seule information que les scientifiques ont à leur disposition pour comprendre le monde qui nous entoure. Au fil des siècles, les scientifiques ont fait "parler" la lumière.
En 1670, Isaac Newton (1643-1727) regarde la lumière blanche du Soleil dans un prisme de verre et s'aperçoit que ce faisceau de lumière est décomposé. Il pense que la lumière est composée de corpuscules.
En 1676, Ole Christensen Rømer (1644-1681) détermine la vitesse de la lumière en observant les satellites de Jupiter.
En 1690, Christian Huygens (1629-1695) énonce que la lumière est constituée d'une série d'ondes propagées à travers l'éther, substrat immatériel qui sert de support dans le vide pour véhiculer la lumière.
En 1801, Thomas Young (1773-1829) obtient une figure d'interférence (image ci-contre), montrant que la lumière est une onde car les ondes peuvent s'ajouter et se soustraire afin de fabriquer des interférences (zones sombres entrecoupées de zones lumineuses). Cette expérience permet de comprendre le comportement et la nature de la lumière.
En 1814, Joseph Von Fraunhofer (1787-1826) remarque des raies dans la lumière visible du spectre solaire. Cet opticien et physicien allemand est le premier à étudier la diffraction de la lumière à l'aide de réseaux optiques (diffraction de Fraunhofer). A cette époque on ne connait pas la raison de la présence de ces raies dans le spectre visible de la lumière. La réponse arrivera bien plus tard.
En 1850, Robert Wilhelm Bunsen (1811-1899) et Gustav Robert Kirchhoff (1824-1887) découvrent que les raies spectrales de la lumière émise par un corps incandescent, constituent une signature permettant d'identifier ce corps. En observant le spectre de la lumière solaire, ils reconnaissent plusieurs éléments chimiques présents sur Terre dont, le césium et le rubidium.
En 1864, James Clerk Maxwell (1831-1879) fait une synthèse des ondes électriques et électromagnétiques. Il détermine que la lumière est une onde électromagnétique et que l'ensemble du spectre électromagnétique est lumière. Ce qui différencie les ondes électromagnétiques entre elles, est la longueur d'onde. Les différentes fenêtres du spectre électromagnétique se caractérisent par une plage de longueurs d'ondes mais aussi par une plage de fréquences.
En 1900, Max Planck résout l'énigme du corps noir, sa formule décrit parfaitement la lumière qu'émet un corps en fonction de sa température. En d'autres termes, une température élevée indique une énergie élevée, une température basse indique une énergie faible.
En 1905, Albert Einstein (1879-1955) explique l'effet photoélectrique, ce sont des photons de la lumière incidente qui arrachent des électrons à la matière.
Les photons agissent comme des quanta d'énergie, ce que Planck avait déjà suggéré, mais c'est Einstein qui le montre. Ces photons disposent donc d'une certaine énergie, c'est elle qui va arracher les électrons du métal. Lorsque nous recevons sur notre peau les rayons lumineux du Soleil, nous ressentons bien l'énergie qu'ils transportent.
La lumière est donc bien constituée de photons au comportement ondulatoire et à chacun de ces photons correspond une énergie. Plus la longueur d'onde du photon est courte et plus il est énergétique.
En 1911, Ernest Rutherford (1871-1937) précise la structure de l'atome et donne une taille au noyau atomique de l'ordre de 10-14 mètre.
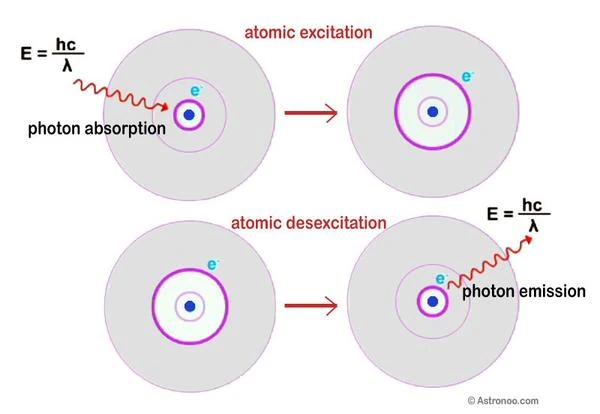
En 1913, Niels Bohr (1885-1962) propose la structure de l'atome d'hydrogène, les électrons sont situés sur des orbites quantifiées. L'électron navigue à une certaine distance, sur une des couches en pelure d'ognon autour du noyau. C'est le principe d'absorption et d'émission de lumière dans un atome.
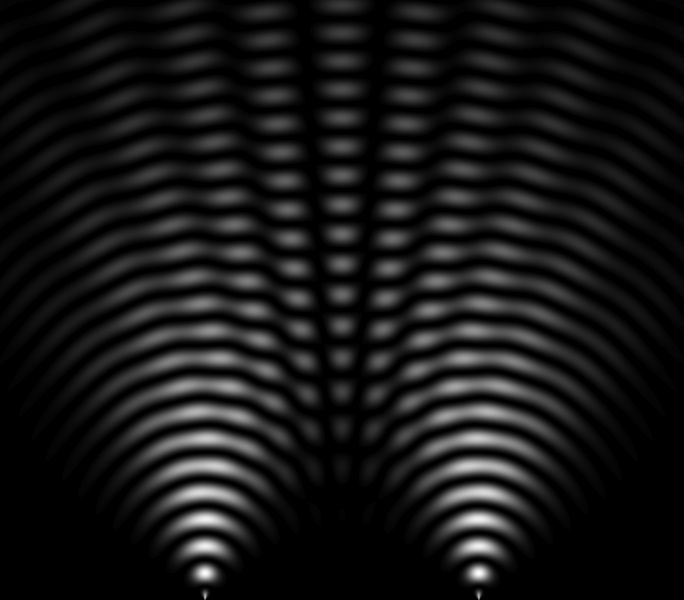
En 1821, Thomas Young (1773-1829), la fameuse expérience des "fentes de Young" consiste à faire interférer deux faisceaux de lumière issus d'une même source. Cette expérience faite avec des photons a été réalisée depuis avec toutes les particules. Avec des électrons dans les années 1920, avec des neutrons dans les années 1950, avec des atomes dans les années 1980 et avec des molécules dans les années 1990.