A luz é a única informação que os cientistas têm à disposição para compreender o mundo ao nosso redor. Ao longo dos séculos, os cientistas fizeram a luz "falar."
Em 1670, Isaac Newton (1643-1727) observou a luz branca do Sol através de um prisma de vidro e percebeu que esse feixe de luz se decompunha. Ele pensou que a luz era composta de corpúsculos.
Em 1676, Ole Christensen Rømer (1644-1681) determinou a velocidade da luz observando os satélites de Júpiter.
Em 1690, Christian Huygens (1629-1695) enunciou que a luz consiste em uma série de ondas propagadas através do éter, um substrato imaterial que serve de suporte no vácuo para transportar a luz.
Em 1801, Thomas Young (1773-1829) obteve uma figura de interferência (imagem ao lado), mostrando que a luz é uma onda porque as ondas podem se somar e se subtrair para criar interferências (áreas escuras intercaladas com áreas luminosas). Este experimento ajuda a compreender o comportamento e a natureza da luz.
Em 1814, Joseph Von Fraunhofer (1787-1826) notou linhas na luz visível do espectro solar. Este óptico e físico alemão foi o primeiro a estudar a difração da luz usando grades ópticas (difração de Fraunhofer). Naquela época, a razão da presença dessas linhas no espectro visível da luz não era conhecida. A resposta viria muito mais tarde.
Em 1850, Robert Wilhelm Bunsen (1811-1899) e Gustav Robert Kirchhoff (1824-1887) descobriram que as linhas espectrais da luz emitida por um corpo incandescente constituem uma assinatura que permite identificar esse corpo. Ao observar o espectro da luz solar, reconheceram vários elementos químicos presentes na Terra, incluindo o césio e o rubídio.
Em 1864, James Clerk Maxwell (1831-1879) fez uma síntese das ondas elétricas e eletromagnéticas. Ele determinou que a luz é uma onda eletromagnética e que todo o espectro eletromagnético é luz. O que diferencia as ondas eletromagnéticas entre si é o comprimento de onda. As diferentes janelas do espectro eletromagnético são caracterizadas por uma faixa de comprimentos de onda, mas também por uma faixa de frequências.
Em 1900, Max Planck resolveu o enigma do corpo negro; sua fórmula descreve perfeitamente a luz emitida por um corpo em função de sua temperatura. Em outras palavras, uma temperatura alta indica alta energia, uma temperatura baixa indica baixa energia.
Em 1905, Albert Einstein (1879-1955) explicou o efeito fotoelétrico; são os fótons da luz incidente que arrancam elétrons da matéria.
Os fótons agem como quanta de energia, o que Planck já havia sugerido, mas foi Einstein quem o demonstrou. Esses fótons, portanto, têm uma certa energia, que arrancará os elétrons do metal. Quando recebemos os raios luminosos do Sol em nossa pele, sentimos a energia que eles transportam.
A luz é, portanto, composta de fótons com comportamento ondulatório, e cada um desses fótons corresponde a uma energia. Quanto mais curto o comprimento de onda do fóton, mais energético ele é.
Em 1911, Ernest Rutherford (1871-1937) especificou a estrutura do átomo e deu um tamanho ao núcleo atômico da ordem de 10-14 metros.
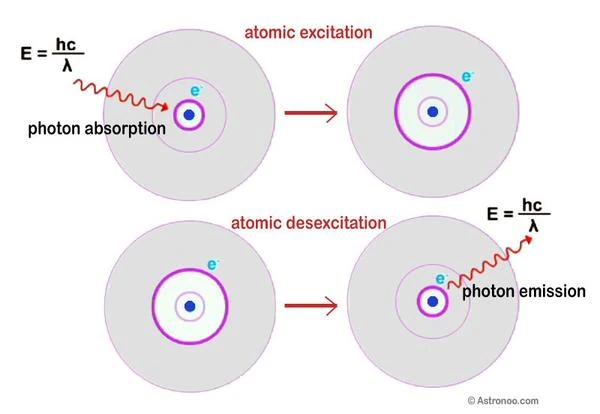
Em 1913, Niels Bohr (1885-1962) propôs a estrutura do átomo de hidrogênio; os elétrons estão situados em órbitas quantizadas. O elétron navega a uma certa distância, em uma das camadas em casca de cebola ao redor do núcleo. Este é o princípio da absorção e emissão de luz em um átomo.
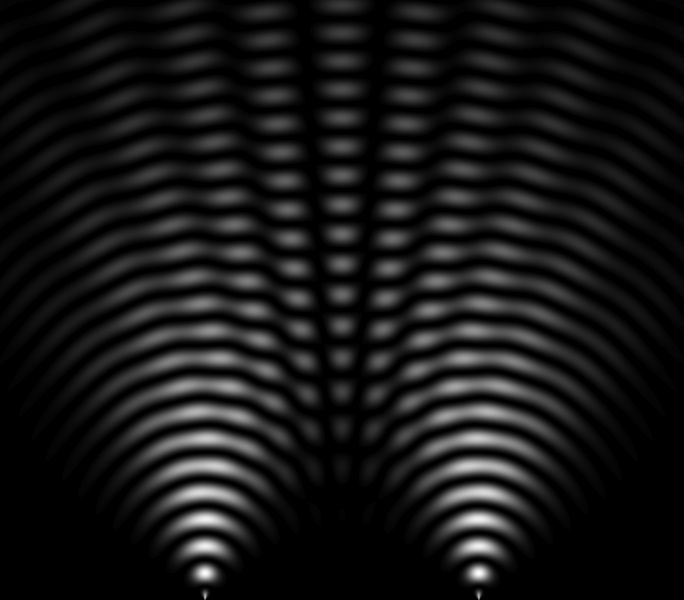
Em 1821, Thomas Young (1773-1829), o famoso experimento das "fendas de Young" consiste em fazer interferir dois feixes de luz da mesma fonte. Este experimento feito com fótons foi realizado desde então com todas as partículas. Com elétrons na década de 1920, com nêutrons na década de 1950, com átomos na década de 1980 e com moléculas na década de 1990.
N.B.:
Energia do fóton E = hν = hc / λ. E é a energia expressa em joules, h é a constante de Planck (6,62 x 10-34), ν é a frequência (número de oscilações eletromagnéticas), c é a velocidade da luz no vácuo e λ é o comprimento de onda. A energia de um fóton é, portanto, infinitamente pequena. Em outras palavras, quanto mais curto o comprimento de onda, maior a frequência e maior a energia.