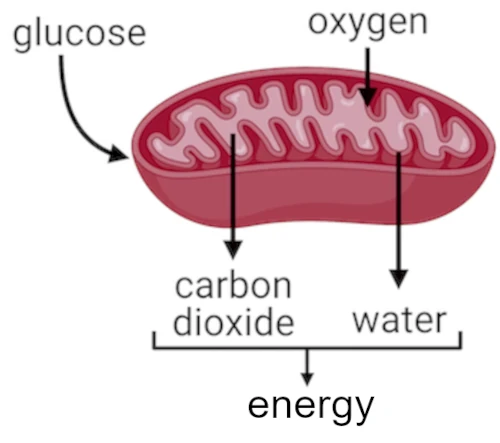
Das Auftreten von Sauerstoff in der Erdatmosphäre vor etwa 2,4 Milliarden Jahren (Tolle Oxidation) ermöglichte die Auswahl und Entwicklung spezialisierter Zellstrukturen und mehrzelliger Organismen. Die Energieeffizienz der aeroben Atmung (die Sauerstoff nutzt) machte diese Entwicklung möglich.
DERDisauerstoff(O₂), die molekulare Form des Sauerstoffgases, das wir atmen, ist für die meisten lebenden Organismen essentiell, da es eine zentrale Rolle bei der zellulären Energieproduktion spielt. Dieser Vorgang heißtAerobe Zellatmungfindet hauptsächlich in den Mitochondrien eukaryontischer Zellen statt.
Ohne Sauerstoff könnten unsere Zellen ATP (Adenosintriphosphat), das universelle Energiemolekül, das alle biologischen Funktionen antreibt, nicht effizient produzieren.
Sauerstoff ist der letzte Elektronenakzeptor in der Elektronentransportkette und befindet sich in der inneren Membran der Mitochondrien. Sauerstoff fungiert daher als letzter Elektronenakzeptor in der Atmungskette und ermöglicht die Energiegewinnung aus Energiemolekülen.Adenosintriphosphat (ATP).
Die Produktion vonATP(C₁₀H₁₆N₅O₁₃P₃) ausGlucose(C₆H₁₂O₆) undDisauerstoff(O₂) ist ein komplexer Prozess namens aerobe Zellatmung (30-38 ATP, produziert durch Glykolyse). Ohne Sauerstoff sinkt die Energieausbeute erheblich (nur 2 ATP pro Glykolyse).
Diese Umwandlung ist der Schlüssel zum Energiestoffwechsel aerober Organismen!
Glucose (C₆H₁₂O₆) ist eine chemische Struktur, die reich an Elektronen ist (12 oxidierbare C-H-Bindungen). Während ihres metabolischen Abbaus werden Glukosebindungen aufgebrochen, wodurch leicht Elektronen für einen Akzeptor wie Sauerstoff freigesetzt werden.
Über die mitochondriale Atmungskette auf Sauerstoff (O₂) übertragene Elektronen erzeugen einen Protonengradienten (H⁺). Der H⁺-Fluss treibt die ATP-Synthase an. O₂ gewährleistet die Evakuierung von e⁻ und die Aufrechterhaltung des Gradienten.
ATP (C₁₀H₁₆N₅O₁₃P₃)
| Bühne | Zellstandort | Reagenzien / Produkte | Ausgebildete ATPs | Reduzierte Coenzyme | Energie (ΔG, kJ/mol) |
|---|---|---|---|---|---|
| Glykolyse | Zytoplasma | C₆H₁₂O₆ → 2 Pyruvate | +2 netto (4 trainiert, 2 verbraucht) | 2 NADH | ≈ –85 |
| Oxidative Decarboxylierung | Mitochondriale Matrix | 2 Pyruvate → 2 Acetyl-CoA + 2 CO₂ | 0 | 2 NADH | ≈ –60 |
| Krebszyklus | Mitochondriale Matrix | 2 Acetyl-CoA → 4 CO₂ | +2 GTP (≈ ATP) | 6 NADH, 2 FADH₂ | ≈ –150 |
| Atmungskette (oxidative Phosphorylierung) | Mitochondriale Innenmembran | NADH, FADH₂ + O₂ → H₂O | +26 bis +34 ATP | NAD⁺, regeneriertes FAD | ≈ –2575 |
| Insgesamt für 1 Molekül Glucose | ≈ 30 bis 38 ATP | 10 NADH, 2 FADH₂ | ΔG ≈ –2870 kJ/mol | ||
Hinweis: :
Das Minuszeichen in ΔG = –2870 kJ/mol zeigt eine Variation des thermodynamischen Potentials, genauer der freien Gibbs-Energie, während der Entwicklung eines chemischen Systems an.
Quellen: Nelson & Cox (Lehninger, 2021), Berg et al. (Biochemistry, 2019), CRC Handbook (2022), Atkins (2020), NIH ODS (2023).
Sauerstoffmangel (Hypoxie) führt schnell zu zellulären Funktionsstörungen. Schon nach wenigen Minuten ohne Sauerstoff beginnen Gehirnzellen abzusterben, weshalb Erstickung so schnell tödlich endet.
Streng anaerobe mehrzellige Organismen sind äußerst selten, da die meisten mehrzelligen Lebewesen für ihren hohen Energiebedarf auf die aerobe Atmung angewiesen sind. Es gibt jedoch einige bemerkenswerte Ausnahmen, vor allem in extrem sauerstoffarmen Umgebungen, wie Henneguya salminicola (Lachsparasit), Loricifera (anoxische Meeresbodenökosysteme), Nematodenwürmer aus tiefen Sedimenten und anaerobe Pilze.
| Element | Symbol | Massenanteil (%) | Physiologische Rolle(n) | Klasse |
|---|---|---|---|---|
| Sauerstoff | O | 65 | Bestehend aus Wasser und organischen Molekülen, Zellatmung | Hauptelement |
| Kohlenstoff | C | 18 | Basis organischer Moleküle (Kohlenhydrate, Lipide, Aminosäuren, DNA) | Hauptelement |
| Wasserstoff | H | 10 | Bestandteil von Wasser, Säure-Basen-Haushalt | Hauptelement |
| Stickstoff | N | 3 | Aminosäuren, Proteine, Nukleinsäuren (DNA, RNA) | Hauptelement |
| Kalzium | Das | 1.5 | Knochenstruktur, Muskelkontraktion, Zellsignalisierung | Makronährstoff |
| Phosphor | P | 1,0 | ATP, DNA, Knochen, Membranphospholipide | Makronährstoff |
| Kalium | K | 0,35 | Osmotisches Gleichgewicht, Nervenübertragung, Muskelkontraktion | Makronährstoff |
| Schwefel | S | 0,25 | Schwefelhaltige Aminosäuren (Cystein, Methionin), Coenzyme | Makronährstoff |
| Natrium | N / A | 0,15 | Nervenübertragung, osmotischer Druck, Darmabsorption | Makronährstoff |
| Chlor | Cl | 0,15 | Flüssigkeitshaushalt, Magensalzsäure (HCl) | Makronährstoff |
| Magnesium | Mg | 0,05 | Enzymatischer Cofaktor, Stabilisierung von ATP und Membranen | Makronährstoff |
| Eisen | Fe | 0,006 | Hämoglobin, Myoglobin, Elektronentransport (Cytochrome) | Essentielles Spurenelement |
| Zink | Zn | 0,003 | Enzym-Cofaktor, Immunsystem, Proteinsynthese | Essentielles Spurenelement |
| Kupfer | Cu | 0,0001 | Redoxenzyme, Eisentransport, Energieproduktion | Spurenelement |
| Jod | ICH | 0,00002 | Schilddrüsenhormone (T3, T4) | Spurenelement |
| Selen | Se | Spuren | Antioxidantien (Glutathionperoxidase), Immunität | Spurenelement |
| Chrom, Mangan, Molybdän, Kobalt | Cr, Mn, Mo, Co | Spuren | Verschiedene katalytische Rollen (Enzyme) | Spurenelemente |
Quellen: Nelson & Cox (Lehninger, 2021), EFSA (2023), ANSES (2022), NIH Dietary Supplements (2023), CRC Handbook.