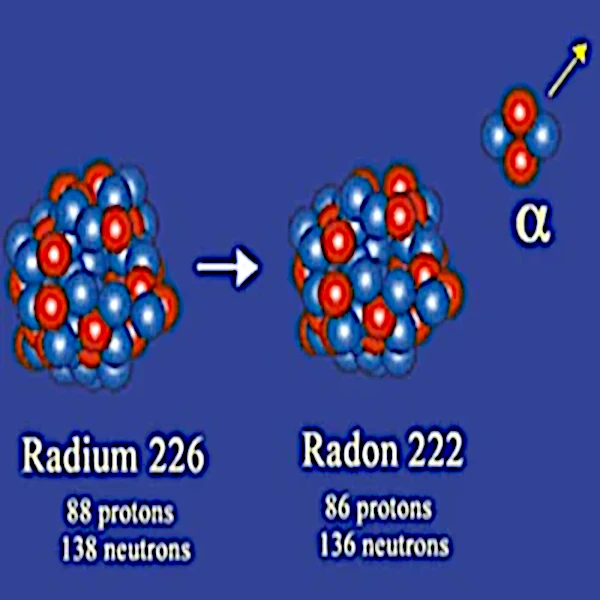
Description de l'image : Désintégration du radium-226. Ce gros noyau de 226 nucléons (88 protons et 138 neutrons) émet une particule alpha composée de deux protons et deux neutrons. Il se transforme alors en noyau de radon-222, lui-même radioactif, contenant deux protons et deux neutrons de moins. La désintégration libère 4,6 millions d’électronvolts d'énergie (MeV). Crédit : Institut national de physique nucléaire et de physique des particules (IN2P3).
Les atomes sont stables lorsque le nombre de neutrons dans le noyau est à peu près équivalent au nombre de protons. Lorsque la différence est trop grande, l'atome devient instable.
Les noyaux lourds des isotopes riches en neutrons de numéro atomique supérieur à celui du fer (N = 26) sont assemblés à de très hautes températures (>109 K) lors de l'explosion des étoiles massives (supernovas).
Cependant tous les noyaux de la matière cherchent une stabilité énergétique parcimonieuse. Ainsi pour revenir vers un état stable, ils doivent transmuter en expulsant de l'énergie sous forme de masse ou de rayonnements. Cela conduit à la désintégration spontanée du noyau. C'est ce que l'on appelle la radioactivité.
La radioactivité est donc un phénomène aléatoire naturel qui se produit dans le noyau, au plus profond de l'atome et qui donne naissance à un nouveau noyau plus stable.
En 1908, Ernest Rutherford (1871-1937) identifie les particules alpha comme étant des noyaux d’hélium 4 composés de 2 protons et 2 neutrons. Ainsi, le noyau stable résultant de la désintégration radioactive possède deux neutrons et deux protons de moins que le noyau instable dont il est issu.
L'émission d'une particule alpha concerne surtout les très gros noyaux comme celui du radium-226 (88 protons et 138 neutrons), du thorium-232 (90 protons et 142 neutrons), de l'uranium-238 (92 protons et 136 neutrons), etc.
De tels noyaux sont instables car, la répulsion coulombienne entre les protons qui croit comme le carré du nombre de protons, est plus forte que l'attraction nucléaire entre les nucléons. C'est à ce moment-là que le noyau expulse un paquet de quatre nucléons.
Pour la matière, c'est la façon la plus rapide et la plus économique de retrouver une stabilité.
Le radium ne possède aucun isotope stable. L'isotope majoritaire du radium découvert par Pierre et Marie Curie le 21 décembre en 1898 par extraction de la pechblende (minerai d'uranium), est le radium-226 dont la période radioactive ou demi-vie est de 1 600 ans (temps nécessaire pour que la moitié des noyaux initialement présents donnent naissance à d'autres noyaux).
Le radium a des propriétés naturelles étonnantes (radioluminescence, production de chaleur spontanée, source radioactive, ...). De plus, il rend l'atmosphère conductrice d'électricité et décharge à distance des condensateurs, ce qui a permis de concevoir le compteur Geiger-Müller. Le compteur Geiger, mis au point en 1928, sert à mesurer un grand nombre de rayonnements ionisants (rayonnement alpha, bêta, gamma et rayons X).
Le radium a été utilisé jusqu'en 1950, pour ses propriétés de radioluminescence, en particulier dans des peintures destinées à l’horlogerie. À partir des années 1920, des maladies professionnelles furent identifiées chez les ouvrières, qui affinaient leurs pinceaux de peinture enrichie en radium, en les portant à leur bouche. Ces maladies conduisirent à une première enquête épidémiologique et à la fermeture progressive des usines.
Du fait de leur masse et de leur charge importantes, les particules alpha sont peu pénétrantes. En général elles peuvent être arrêtées par la peau. Cependant si elles sont ingérées, elles deviennent dangereuses. Des doses suffisamment fortes peuvent provoquer des cancers.
N. B. : L'ionisation est l'action qui consiste à enlever ou ajouter des charges électromagnétique à un atome.
1997 © Astronoo.com − Astronomie, Astrophysique, Évolution et Écologie.
"Les données disponibles sur ce site peuvent être utilisées à condition que la source soit dûment mentionnée."
Comment Google utilise les données
Mentions légales
Sitemap Français − Sitemap Complet
Contacter l'auteur