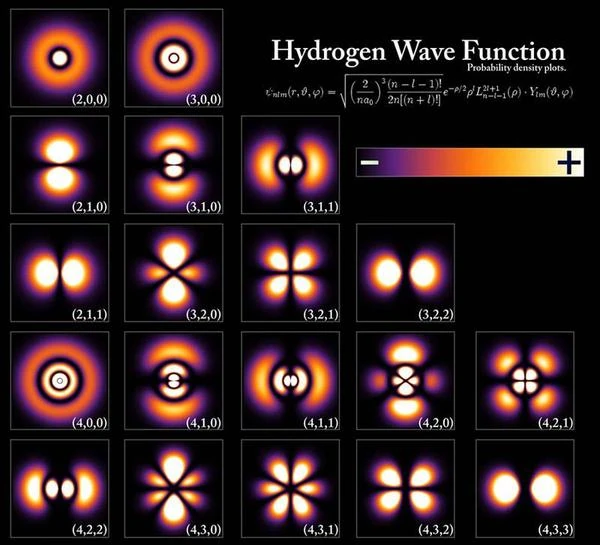
Descripción de la imagen: Las orbitales atómicas del átomo de hidrógeno se representan según la energía del electrón y su momento angular. El nivel de energía aumenta de arriba abajo (n = 1, 2, 3, 4, 5) y el momento angular aumenta de izquierda a derecha (l = s, p, d, f, g). Colores: Negro: densidad de probabilidad cero (el electrón nunca va allí). Blanco: densidad máxima (el electrón pasa frecuentemente). Rojo anaranjado: densidad intermedia. Números cuánticos: n: número cuántico principal, define el nivel de energía. l: número cuántico secundario u orbital, define las subcapas (s, p, d, f, g...). m: número cuántico magnético, representa las orientaciones de las orbitales atómicas. s: número cuántico de espín, cuantifica el "momento angular" intrínseco del electrón. Esta representación muestra la densidad de probabilidad de encontrar el electrón en diferentes regiones alrededor del núcleo. Fuente de la imagen: GNU Free Documentation License.
Es al examinar los constituyentes más pequeños de la materia que los científicos (siglo XX) explicarán el funcionamiento de todo el universo.
Un átomo está compuesto por un núcleo alrededor del cual se mueven uno o más electrones. Lo que caracteriza al núcleo es su número de protones (Z), que va de 1 a 110, y determina el elemento, por ejemplo, el hierro (Fe26) tiene 26 protones, 26 es su número atómico (Z). El número de neutrones (N), que va de 0 a 160, caracteriza los isótopos del elemento, por ejemplo, el hidrógeno (H1) tiene un protón y ningún neutrón, el deuterio (H2) tiene un protón y un neutrón, el tritio (H3) tiene un protón y dos neutrones.
Estas tres formas de hidrógeno tienen solo un electrón, ya que solo hay una carga eléctrica, el único protón.
Atención, solo en el caso del hidrógeno se les da un nombre diferente a los isótopos del elemento; en todos los demás casos, solo se indica el número de nucleones, lo que permite encontrar el número de neutrones. Por ejemplo, el hierro (Fe26) tiene varios isótopos, entre ellos Fe56, que tiene 30 neutrones, Fe57 tiene 31 neutrones, Fe58 tiene 32 neutrones, el número de neutrones diferencia los isótopos.
En el átomo, son los electrones los que dan consistencia a la materia, aunque es muy ligero (≈10-27 g). El protón es ≈2000 veces más pesado y concentra la mayor parte de la masa del átomo (99.99%). Para los átomos estables, la masa está comprendida entre 1.674×10-24 g para el Hidrógeno y 3.953×10-22 g para el Uranio.
Desde 1811, conocemos el tamaño aproximado de un átomo; Amedeo Avogadro (1776-1856) estimó el tamaño de los átomos en 10-10 metros (Angstrom), es decir, un poco más de una cienmilésima de milímetro. En 1911, Ernest Rutherford (1871-1937) descubrió el núcleo atómico.
Rutherford especificó la estructura del átomo al bombardear una lámina de oro con partículas de la desintegración radiactiva del uranio. Dio un tamaño al núcleo atómico del orden de 10-14 metros.
Rutherford representó cada átomo como un mini sistema solar, con el núcleo en el centro y los electrones orbitando como planetas.
Desde la llegada de la mecánica cuántica (década de 1920), la imagen del núcleo es inquietante; el núcleo ya no es un sistema compuesto de corpúsculos asociados. El núcleo, regido por la mecánica cuántica, no es observable porque para observar los nucleones dentro del núcleo, habría que iluminar las partículas con una luz tan intensa que el núcleo se desintegraría instantáneamente.
Lo mismo ocurre con el electrón; ya no representamos al electrón como un corpúsculo que gira en una órbita bien definida alrededor del núcleo. El electrón no es ni una onda ni un corpúsculo; sin embargo, hablamos de la dualidad onda-corpúsculo, que es el fundamento de la mecánica cuántica. El electrón no sigue una trayectoria única; probablemente se encuentra en una región alrededor del núcleo llamada orbital atómica.
Desde 1924, toda la materia está dotada de una onda asociada, según la hipótesis de Louis De Broglie (1892-1987). Con esta hipótesis, generalizó la "dualidad onda-partícula" introducida para la luz por Max Planck (1858-1947) a principios del siglo XX a todas las partículas de la materia.
Todas las partículas subatómicas, por lo tanto, tienen una longitud de onda. La longitud de onda λ de una partícula subatómica y su cantidad de movimiento p están relacionadas por la ecuación: λ=h/p, donde h es la constante de Planck, p es la cantidad de movimiento, es decir, el producto de la masa por el vector velocidad (p=mv). El electrón tarda unos 150 attosegundos (1.5×10−16 segundos) en "orbitar" el átomo de hidrógeno.
Gracias a la fórmula de Einstein (E=mc2), toda la materia está dotada de una energía asociada. En otras palabras, cuanto más pequeña es la longitud de onda, mayor es la energía (E=h/λ). Esta energía modificará la forma de los átomos. Así se establecen los fundamentos de la mecánica cuántica.
La materia está compuesta de partículas muy pequeñas (electrones, neutrinos, quarks) que tienen masa, carga, energía, dimensión, onda y espín.
En 2013, aún no podemos ver las partículas del núcleo atómico, sino solo la capa exterior del átomo, es decir, su nube electrónica. La nube electrónica ocupa toda la extensión espacial del átomo, ya que es unas 10,000 veces más grande que su núcleo.
En la mecánica cuántica ondulatoria, una partícula está representada por una función de onda (vector de estado), pero es muy difícil conceptualizar el concepto fundamental de la mecánica cuántica o el estado cuántico de un sistema.
En 1927, Max Born (1882-1970) dio una interpretación de la función de onda donde el cuadrado de la función de onda representa la probabilidad de encontrar la partícula en un lugar preciso cuando se realiza una medición.
Una función de onda es, por lo tanto, una amplitud de probabilidad o una densidad de probabilidad de la presencia del sistema en una posición dada en un momento dado. Esta función tiene un valor complejo. Si un número real o un valor real representa, por ejemplo, la longitud de un segmento en una línea, un valor complejo está representado por un vector en un plano. Este vector no solo tiene una longitud en el espacio, sino también una fase que corresponde a la dirección del vector.
Si ya no representamos al electrón como una partícula puntual en una órbita regular alrededor de un núcleo, ¿cómo podemos hacernos una idea de él?
El electrón no sigue una trayectoria única alrededor del núcleo; se encuentra en algún lugar de una "vasta región" llamada nube electrónica u orbital atómica. El estado de un electrón, por lo tanto, está representado por este volumen de espacio alrededor del núcleo en el que está deslocalizado. El estado fundamental de un átomo de hidrógeno mide aproximadamente 1 angstrom, es decir, 10-10 metros.
Para hacerse una idea del electrón en esta región, simplemente imagine un grano de arroz de unos 5 mm moviéndose en una esfera de unos 50 metros de diámetro. Pero no siempre es una esfera; la forma de esta región del espacio atómico depende de la energía del electrón y de su momento angular.
Las orbitales del electrón pueden adoptar diferentes formas características según la naturaleza del átomo, por ejemplo, la orbital del átomo de hidrógeno en la primera fila en la parte superior de la imagen tiene una forma esférica, la orbital en la segunda fila tiene la forma de dos gotas de agua, la orbital en la tercera fila tiene la forma de cuatro gotas de agua. En resumen, la orbital corresponde a la región del espacio donde el electrón está deslocalizado; el estado del electrón está en una superposición de todas las posiciones posibles dentro de la orbital atómica, cuya forma varía. La forma de la orbital cambia cuando se excita el átomo, como en la primera fila. Si se excita aún más el átomo, la forma de la orbital cambia nuevamente, como en la segunda fila o segunda capa electrónica. En un estado muy excitado llamado "estado de Rydberg," los electrones están deslocalizados en un toro de "radio muy grande" que puede medir hasta 1000 angstroms; el número cuántico principal n (número de la capa) es muy alto, entre 50 y 100.
N. B.: Un electrón, atraído por la carga positiva del núcleo, no puede "pegarse al núcleo" porque eso significaría que la extensión espacial de su función de onda se reduce a un punto (sin velocidad ni momento angular). La ecuación de Schrödinger dice que un electrón, en las inmediaciones del núcleo, se encuentra en una orbital con una geometría determinada por los números cuánticos que satisfacen esta ecuación. En resumen, un electrón está confinado en las inmediaciones del núcleo por el pozo de potencial electrostático. Cuando la energía potencial es creciente, se dice que la partícula se mueve en un pozo de potencial.